5 概述
经颈内静脉肝内门体分流术用于门静脉高压症的手术治疗。 经颈内静脉肝内门体分流术(TIPS)是20世纪90年代治疗门静脉高压症的新方法。该方法创伤小、成功率高、并发症低、适应证广、降低门静脉压力显著、控制食管静脉曲张出血疗效可靠。TIPS作为门静脉高压症治疗措施之一,特别适用于晚期肝硬化患者,在门静脉高压症治疗中有着极为重要的作用。

门静脉系统的两端均为毛细血管网,是一种无瓣膜的低压力静脉系统,它包括腹腔消化道内脏和肝脏两个系统。
门静脉主干由肠系膜上静脉和脾静脉于胰颈部后方汇合而成,其长度为6~8cm(图1.14.2.7-0-2)。门静脉主干形成后,经肝十二指肠韧带上行入肝分成左右干,并不断分支变小,最终于肝小叶的窦状隙以毛细血管网的形式与肝动脉毛细血管相汇合,血液流入肝小叶中央静脉,再经肝静脉入下腔静脉。
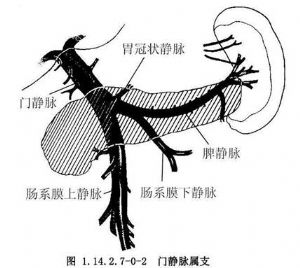
门静脉系统中,门静脉主干的解剖学变异甚少,然而,门静脉的主要属支,如肠系膜上静脉、脾静脉、胃冠状静脉的解剖学变异则不少见,并其有一定的临床意义。
6 关于门静脉高压
6.1 生理
门静脉系统和腔静脉系统之间,在肝外存在多种有着重要病理生理作用的交通支(图1.14.2.7-0-3),当门静脉压升高至一定阈值时,它们将开放形成门腔间侧支循环,分流门静脉系统血流。在门腔中,临床以胃冠状静脉(胃左静脉)、胃后静脉及胃短静脉与上腔静脉的奇静脉和半奇静脉与胃底、食管下段交通侧支最为重要。因为,在门静脉高压(protal hypertension,PHT)时,它是门体静脉间主要的交通循环通道,而由此产生的食管胃底静脉曲张及其破裂出血也是PHT所引起的最严重并发症。
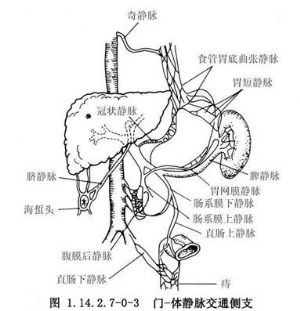
另外,在肝内窦前小叶间汇管区,肝动脉与门静脉之间亦存在许多交通支。这些动静脉交通支一般仅在肝硬变和肝内血流量增加时才开放。
门静脉主干及其属支脾静脉、肠系膜上静脉和胃冠状静脉是常用的门体分流术血管,而肠系膜上静脉作分流术的部位一般取其外科干。肠系膜上静脉外科干系指回结肠静脉与Henle干或其分支分出处间的肠系膜上静脉段。Henle干则为右结肠静脉与胃网膜右静脉汇流的静脉干。
6.2 病理
肝脏是人体内惟一有动脉和静脉双重供血的器官,其平均血流量为每分钟1500ml,几乎达心脏输出量的25%。其中,门静脉所供给的血量占肝总血流量的2/3。在门静脉血流中,约75%收集腹腔内消化器官,25%来自脾脏的血液。正常时门静脉的压力约为13~24cmH2O。若门静脉系统血液回流受阻或门静脉血流量增加,均会使门静脉压力升高。当门静脉压力超过25cmH2O,即定义为PHT;而当表现有脾脏肿大、门腔静脉间侧支循环形成以及腹水等征象时,临床上诊断为门静脉高压症。
PHT的病因很多,但在临床上约90%~95%的门静脉高压症由肝硬化所致,特别是肝炎后肝硬化为国内最常见的病因,其次是血吸虫病后肝硬化,该病在已往的流行区还不少见,而酒精性肝硬化在近年也有增多。关于PHT的分类,随着对本病研究的深入,其分类方法亦显繁杂,就手术学角度而言,分肝前、肝内及肝静脉流出道梗阻性三型即可。
肝前型PHT的常见原因为门静脉及其属支血栓形成、门静脉海绵样变,尤其是血栓形成,几乎占儿童PHT病因的50%;另外,在一些胰腺炎症或胰腺肿瘤病人中,可见单纯的脾静脉受压或血栓引发所谓的“左侧门静脉高压”(left-sided portal hypertension),或称区域性门静脉高压(regional portal hypertension)。此种PHT只有脾胃静脉的高压,而门静脉和肠系膜上静脉的压力正常,胃网膜左静脉成为主要的侧支血管,治疗上仅作脾切除就能解除PHT问题。肝静脉流出道梗阻型PHT又称布-加综合征(Budd-Chiari syndrome),多由肝静脉和(或)下腔静脉阻塞引起。
6.3 手术目的
时至今日,除肝脏移植术外,其他各种手术并不能改善肝脏原有的病变,换言之,手术只能治标不能治本。因此,无论分流术、断流术加脾切除术抑或分流术加断流术,手术目的尚限于防治食管和(或)胃底曲张静脉破裂出血以及切除巨脾治疗脾功能亢进。就此而言,一种理想的手术应能达到以下目的:①止血效果好,再出血率低;②手术对肝脏功能影响小,以免手术加重肝功能损害,引发肝功能衰竭和肝性脑病;③手术并发症少,病死率低;④术后远期效果满意,病人生存质量高。
6.4 手术适应证
(1)食管和(或)胃底曲张静脉破裂出血,经非手术治疗无法控制出血时,若病人肝脏及其他生命器官功能允许,宜不失时机地采取手术止血。
(2)食管和(或)胃底曲张静脉破裂出血,经非手术治疗控制出血后,为防再出血可行择期手术治疗。这是一种被医学界广为接受的手术适应证。因食管和(或)胃底曲张静脉一旦发生破裂出血,一年内再度出血的可能性在70%以上。
(3)食管和(或)胃底静脉重度曲张,内镜检查提示有出血倾向的病人,亦可行择期手术治疗,以防曲张静脉(首次)破裂出血的发生。有关该适应证,临床尚有一定的争议。主张手术的理由为尽管只有1/3左右的食管胃底曲张静脉并发破裂出血,但大出血的病死率很高;反对手术的观点是约2/3的食管胃底静脉曲张病人经非手术疗法可预防出血的发生,而毋需手术治疗。
(4)巨脾合并明显脾脏功能亢进和影响生活质量的PHT病人,可择期行脾切除术。若伴有中度以上食管和(或)胃底静脉曲张,也可同期加做预防出血的手术。
6.5 术式选择
(1)急诊手术:一般选择断流术。若肝功能许可,技术条件成熟,方可施行急诊分流术。对断流术后再发出血者,可行限制性的门—腔或肠—腔静脉分流术;特殊情况下,可考虑食管下端和胃近侧切除术。手术应由经验丰富的外科医师主刀实施。
(2)择期手术:原则上讲,在决定治疗方案前,应综合分析以下几方面情况:①病人条件,如全身情况、肝脏功能、凝血机制。有时,还应根据术中发现,如肝脏大小、色泽、硬度以及内脏静脉曲张情况改变术式;②所选手术对门静脉供肝血流量影响;③现时已将门静脉循环分为肠系膜和胃脾功能区,后者对食道胃底静脉曲张最有影响。因此,手术要重点针对胃脾区门静脉系统的问题;④就手术一般原则来说,在确保疗效相仿时,应选择创伤小、安全系数高,并发症少,生理功能破坏小,术后生存质量好和远期生存率高的手术;⑤还应考虑手术人员的技术问题及相关的手术设备条件等因素。
就手术原理来讲,断流术并没有影响门静脉的供肝血量,相反能维持一定的门静脉压力,增加门静脉向肝血流灌注,且手术操作较简单,易于掌握和推广应用,止血效果确切,并发症、死亡率和肝性脑病发生率均低于分流术。另外,断流术对病人条件较分流术要求要低,手术适应证较宽。因此断流术在现时国内已成为治疗PHT的主流术式。据统计,近年国内行断流术与分流术的比例为2.86∶1。断流术的主要缺点是部分文献报道的术后再出血率较高(16.3%~29.6%),究其原因是胃冠状静脉的高位食管支以及胃后静脉被遗漏,以致断流不长久所造成。此外,近年有文献报道断流术后PHG发生率高达30%。在断流术的诸多方法中,以Sugiura手术及其改良术式的断流为彻底,疗效较满意,有报道再出血率仅1.5%~3%。
门体静脉分流术对门静脉系统降压效果满意,止血率及食管静脉曲张和腹水消失率高,再出血率低,以上优点使分流术在欧美地区盛行,它也一度是国内治疗PHT出血的主要术式。但是,分流术可引发两个严重并发症:①肝功能损害加重;②分流性脑病,以致严重影响病人的生存质量,降低其远期生存率。原因是各种分流术均使肝脏的门静脉血流灌注量减少,一些门体完全分流术(如传统的门腔、脾肾、肠腔分流术等),甚至可使肝动脉的血流经门静脉逆流入下腔静脉,导致术后肝功能迅速恶化,抑或肝功能衰竭而死亡。为此,自20世纪60年代中后期及70年代初,有人开展了选择分流术和限制性分流术,其目的是在降低门静脉压力的同时,维持一定的向肝血流,取得了一定的效果;然而无论是选择性分流术还是限制性分流术,仍有14%和10%的肝性脑病发生率,以及7%和11.4%的术后再出血率,疗效不尽如人意。简而言之,门体分流术经历了近乎百年的发展,推广和改进过程几经周折起落,对其的评价尤如其他PHT手术术式,仍有许多争议,但应该说它依然是治疗PHT出血的一类重要术式。目前临床上常用的门体分流术有远端脾肾分流术、冠腔静脉分流术、限制性门腔静脉侧侧分流术、限制性门腔静脉架桥分流术,限制性肠腔静脉侧侧分流术、限制性肠腔静脉架桥分流术以及近端脾肾分流术。
分流+断流联合手术:随着对PHT研究的深入,人们已认识到治疗PHT食管胃底曲张静脉破裂出血的理想术式是在有效降低门静脉压力的同时,又能最大限度地维持门静脉向肝血流量,以免手术给肝脏功能带来进一步损害。但实际情况是单纯的断流术或分流术,因术后再出血率或术后高脑病发生率而难以达到上述手术目的。鉴此,现已不断有学者提出并偿试行分流+断流联合手术治疗PHT的临床报道,意图通过断流与分流的优势互补,以获得更好的治疗效果。目前常用的联合手术有肠腔H形架桥分流+脾切除+贲门周围血管离断术、脾肾静脉分流+脾切除+贲门周围血管离断术、TIPS+改良Sugiura手术等。但是,有关联合手术的临床实践结果尚有限,效果并非理想,而争议很多,因联合手术对病人的条件要求更高,手术创伤亦较单纯分流或断流手术更大,多数学者持反对意见,其价值或合理性尚待探讨。
6.6 手术时机
PHT病人,特别是肝炎后肝硬化患者,病情多较复杂,术后并发症多,远期预后也较差。病人术前的全身情况和肝功能状态与预后密切相关,特别是肝功能代偿的好与差,往往为手术治疗成与败的决定因素。有报道Child A、B、C级病人的手术病死率分别为2%、10%和50%左右。所以,对Child-Pugh肝功能分级属C级者,原则上不行择期手术治疗。
7 适应症
经颈内静脉肝内门体分流术适用于:
1.门静脉高压症伴食管静脉曲张破裂大出血经非手术治疗无效者。经内镜硬化剂注射、套扎和药物是治疗食管静脉曲张破裂大出血的重要方法,但是仍有10%~20%患者出血难以控制需行TIPS治疗,通过肝内分流道降低门静脉压力,控制出血以挽救患者的生命。
2.预防食管静脉曲张再出血。TIPS术后1年分流道通畅率25%~66%,出血复发率18%~31%;从门静脉高压症远期疗效考虑,TIPS不宜作为首次食管静脉曲张破裂出血的首选方法,更不应作为食管静脉曲张的预防性治疗。
3.断流术后再出血。断流术后腹腔内广泛粘连严重影响再次手术治疗,TIPS不受腹腔粘连的影响,应为断流术后再出血的首选方法。由于断流术改变了门静脉系统的正常解剖,血管直径缩小,走向异常,增加了TIPS的操作困难。同时,断流术增加门静脉血栓发生率,临床应用时应加以注意。
4.顽固性腹水。TIPS仅适用于以门静脉压力增高为主要原因的顽固性腹水患者。TIPS术后50%~92%患者腹水部分或完全消退,1年生存率为33%~52%,其中腹水显著消退者1年生存率高达75%~80%。
5.布加综合征。TIPS能够有效地治疗肝静脉病变所致门静脉高压。急性布加综合征行TIPS治疗,门静脉立即减压以保存肝功能储备,减少肝功能衰竭;慢性布加综合征行TIPS治疗,缓解肝脏瘀血,增加肝脏供血,术后肝功能明显改善,1年生存率为80%。
6.肝移植前的准备性治疗。TIPS是肝移植的桥梁,为晚期肝硬化伴食管静脉曲张出血患者进行肝移植等待供体提供了时间,同时,TIPS不影响肝移植的血管解剖,门静脉压力的降低又显著减少移植过程中的出血。作为肝移植前准备性治疗,支架应位于肝实质内,但肝外支架并不构成移植手术的反指征。
7.断流术的术前准备。TIPS作为断流术的术前准备,降低门静脉压力,改善门静脉循环,有效地预防断流术后门静脉血栓和胃黏膜瘀血;术中门静脉造影显示冠状静脉解剖,提高断流的彻底性;分流道的长期通畅能预防断流术后新的侧支血管的形成。断流术是TIPS的补充,避免了分流道过大所致的肝功能损害和分流道过小、狭窄和阻塞所致的出血复发。两者互为补充,共同提高门静脉高压症的临床疗效。
8 禁忌症
1.严重肝功能损害 重度黄疸(总胆红素>171mmol/L),SGPT显著升高(>500U),PT明显延长(>20s),严重肝性糖尿病。
2.门静脉狭窄或阻塞 门静脉狭窄或阻塞影响肝静脉向门静脉穿刺、肝内分流道的建立和门静脉血液分流量。虽有作者采用经皮经肝门静脉穿刺疏通血栓,再行TIPS操作,但技术难度大,成功率低。断流术后或硬化剂注射治疗后门静脉血栓发生率较高,原发性肝癌患者亦易并发门静脉癌栓,对这类患者术前需认真筛选。
3.肝脏占位性病变 肝右静脉向门静脉反复穿刺可导致位于第1、2肝门部肿瘤的血行转移。远离分流道建立部位的肝癌患者合并食管静脉曲张破裂出血仍可采用TIPS治疗。
4.器质性心脏病 TIPS术后回心血流量增加25%~30%,加重心脏负荷,易发生心功能衰竭。
5.严重肝性脑病 TIPS可诱发或加重肝性脑病,值得注意的是对因大出血所致肝性脑病患者,TIPS控制出血后即可改善症状。
9 术前准备
9.1 1.肝功能评估
常用的肝功能评估方法是Child分级和Child-Pugh评分标准。白蛋白、胆红素、SGPT、PT和腹水是肝功能评估的主要指标。活动性肝炎、严重肝损害、肝功能评分>11者慎用TIPS治疗。
9.2 2.超声多普勒
检测内容包括肝、脾大小、腹水、门静脉主干及左右分支的管径、血流速度和方向、血流量,特别注意有无门静脉血栓和肝脏占位性病变。超声多普勒检测门静脉系统的作用在于筛选病人、研究手术前后门静脉血流动力学变化和早期发现肝内分流道的狭窄或阻塞。
9.3 3.选择性肠系膜上动脉造影
间接显示门静脉主干及其分支,了解门静脉系统的解剖、侧支循环、血流方向和反流情况,进一步排除门静脉血栓,并为肝静脉向门静脉肝内分支穿刺定向和定位。该项检查应在TIPS操作过程中进行。
9.4 4.磁共振成像(MRI)和电子束CT血管成像
根据磁共振成像和电子束CT血管成像显示的肝静脉和门静脉肝内分支的距离,选择肝静脉向门静脉分支穿刺点、穿刺深度和角度,有助于提高门静脉穿刺成功率。
11 手术步骤
1.TIPS操作在C-2000 DSA X线机监视下进行。
2.患者平卧后头偏向左侧,显露右侧颈部血管三角区,1%普鲁卡因注射液行局部麻醉,穿刺颈内静脉,穿刺成功后置入导丝,经上腔静脉、右心房至下腔静脉。沿导丝将Rups-100导管装置送入下腔静脉并选择性送入肝右静脉,分别行造影和测压。
3.以肝静脉距下腔静脉入口2~3cm为穿刺点,向前调整导向器方向,穿刺方向为前下方,穿刺深度约3~4cm,退出穿刺针,回抽5F导管,回抽血流通畅,注入造影剂显示门静脉肝内分支后,置入BENTSON软头导丝经门静脉主干至脾静脉或肠系膜上静脉,沿导丝将5F导管送入门静脉主干,进一步证实导管经门静脉肝内分支进入主干,此时则示门静脉穿刺成功。
4.采用AMPLATZ超强导丝取代BENTSON导丝送入门静脉和肠系膜上静脉,沿导丝将同轴的Rups-100导管装置经肝组织突破门静脉分支推入门静脉主干,分别行门静脉造影和测压,退出5F导管、金属导向器和导管鞘,保留引导鞘于门静脉内。
5.沿导丝送入直径8或10mm气囊扩张管,分别扩张门静脉、肝实质及肝静脉,门静脉和肝静脉腰形压迹消失后退出气囊扩张管,向门静脉内推注造影剂无外溢现象后放置内支撑,以门静脉压迹为标志,置入可扩张性内支撑,内支撑应覆盖整个肝内分流道,门静脉造影示门静脉血流经分流道进入右心房。
6.若食管静脉曲张仍有显示,选择性插管至冠状静脉行栓塞治疗。
7.再行门静脉和肝静脉测压,拔除引导管,保留5F导管于门静脉内,5F导管经颈内静脉引出(图1.14.2.7-1A~E)。
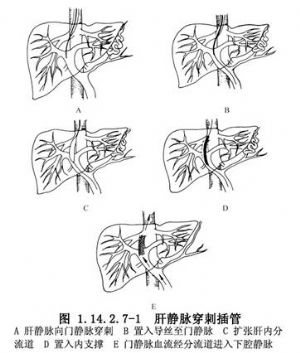
TIPS操作成功的标志:①门静脉造影示门静脉血流经肝内门体分流道进入肝静脉、下腔静脉和右心房;②冠状静脉和食管曲张静脉消失;③门静脉压力下降12~15cmH2O,门体压力梯度<12mmHg;④食管、胃底静脉曲张出血停止。
12 术中注意要点
12.1 1.门静脉穿刺
从肝静脉向门静脉肝内分支穿刺是TIPS操作中最为关键的步骤,这一操作步骤决定TIPS操作能否成功。肝静脉穿刺点多位于肝右静脉距下腔静脉开口2~3cm,门静脉穿刺点应位于左右分支距门静脉主干1~2cm及肝内门静脉二级分支,若穿入门静脉左右交叉,应警惕少数患者左右分叉位于肝外,在此部位扩张或置入内支撑可能会导致致命性腹腔大出血。穿入后推注少量造影剂显示门静脉分支对判断门静脉穿入部位极为重要。
12.2 2.血管内支撑的选择和放置
分流道口径的选择取决于肝功能状况和治疗方式,一般采用分流道口径为10mm,门静脉压力梯度<12~15mmHg,若肝功能状况较差或TIPS与断流术和冠状静脉栓塞联合运用,分流道口径可<8mm,而内支撑的直径应大于分流道直径的10%~20%以防移位。分流道肝实质段长度约3~3.5cm,支撑在分流道内应向肝静脉和门静脉突出1~2cm,内支撑长度为6~7cm。为防止分流道的急性阻塞,内支撑的正确放置非常重要。内支撑应完全覆盖肝内分流道,放置时以门静脉压迹为标志,放置后再行门静脉造影进一步确认内支撑是否完全分流道,特别注意肝静脉段,若发现分流道狭窄或门静脉压力下降不显著,应及时修整以保证分流道的通畅。对TIPS术后准备行肝移植患者,应控制内支撑肝静脉段长度,防止支撑过长影响肝移植的进行。
13 术后处理
经颈内静脉肝内门体分流术术后做如下处理:
13.1 1.一般处理
术后24h内密切观察生命体征和腹部情况,注意腹痛、腹胀等症状,及时发现腹腔内出血;观察心和肺功能,防止急性心功能衰竭和肺水肿;生命体征平稳时使用速尿,促进造影剂的排泄;计24h尿量,测腹围和体重的变化;注意观察股动脉和颈内静脉穿刺点有无血肿和皮下瘀斑;检测肝、肾功能、电解质、PT、血常规、血小板和血氨浓度。
13.2 2.预防肝性脑病和肝功能衰竭
①限制蛋白摄入量;②及时纠正水、电解质平衡紊乱;③口服乳果糖,10~20g/次,每日3次,根据每日大便次数调整乳果糖的用量。乳果糖能酸化肠道,促进大便排泄,减少肠道对氨的吸收,是预防和治疗肝性脑病的重要药物;④静滴支链氨基酸,纠正氨基酸代谢失衡;⑤应用降氨药物如精氨酸、谷氨酸等降低血氨浓度;⑥其他保肝药物如前列腺素E、门冬氨酸钾镁等;⑦应用血浆和白蛋白等,纠正低蛋白血症,改善全身营养状况。
13.3 3.抗凝剂的应用
采用微量泵持续24h经门静脉留置导管输入肝素注射液,剂量为每日4000~6000U,持续使用2周。
13.4 4.门静脉留置导管的管理
导管颈部入口处每周更换3次敷料,碘伏局部消毒,同时检查局部有无红肿和分泌物,将浸有碘伏液的明胶海绵盖于导管入口处,再覆盖无菌纱布,四周密封。每周2次行导管入口处细菌培养。一旦出现导管阻塞或疑有导管感染及时拔管。
14 并发症
14.1 1.腹腔内出血
腹腔内出血是TIPS术后最严重和最危险的并发症,发生率为3%~7%,在TIPS开展的早期,由于采用经皮经肝门静脉穿刺造影引导TIPS操作,腹腔内出血发生率较高。随着引导门静脉穿刺方法的改进,显著降低了腹腔内出血的发生率。引起腹腔内出血的主要因素是:①经肝静脉向门静脉穿刺过深;②门静脉左右支分叉在肝外,而分流道建于肝右静脉与门静脉左右支分叉之间;③穿透肝外门静脉主干后壁。穿出肝外引起的腹腔内出血多为自限性,分流道建于肝外或门静脉主干导致的出血后果较为严重。预防措施:①术前仔细了解门静脉肝内分支的解剖;②严格掌握穿刺深度;③门静脉穿刺成功后准确辨认门静脉穿刺点的位置;④肝内分流道扩张后手推少量造影剂观察有无异常瘘道的形成。治疗:①因穿出肝外引起的出血,在完成TIPS同时密切观察生命体征和腹部情况;②穿透门静脉主干后壁和门静脉左右分支交叉处引起的出血,立即终止TIPS操作,造影显示出血点采用气囊扩张管压迫出血点,在气囊压迫止血的同时立即剖腹探查,控制第1肝门,吸净腹腔内积血,行出血点缝扎止血和门静脉修补术,生命体征平稳时再行断流术。
14.2 2.胆道出血
发生率为1%~4%,门静脉穿刺过程中虽可穿入肝内胆道分支,抽出淡黄色胆汁,注入造影剂见胆道显影,肝内分流扩张亦可损伤肝内细小胆管,然而,胆道出血极为少见,只有门静脉或肝动脉与胆道相通出现血管胆管瘘才会有术后发热、黄疸、腹痛、便血或呕血等症状。大多数患者症状较轻,病程为自限性,仅需非手术治疗,严重者须行肝动脉造影和直接门静脉造影,了解内瘘发生的原因和部位。诊断明确后行肝动脉或门静脉分支栓塞、TIPS分流道阻塞或置入带膜内支撑,必要时剖腹探查、肝动脉结扎和T形管引流。
14.3 3.肝动脉损伤
肝硬化患者肝动脉直径显著增粗,血流量增大,肝静脉向肝门部门静脉穿刺时可能穿入肝动脉造成损伤。肝动脉损伤时表现为肝动脉血栓形成或腹腔内出血,无论哪种形式的肝动脉损伤都是致命的。肝硬化时门静脉血管阻力增加,肝动脉血管阻力降低,肝动脉血流代偿性增加以维持肝脏功能,一旦肝动脉损伤必将减少肝脏血供,同时肝内门体分流建立后部分门静脉血流进入体循环,肝脏血供的急剧减少将导致急性肝功能衰竭。肝动脉损伤还可表现为动-门静脉瘘,TIPS术后肝内分流道通畅,门静脉压力无明显变化,超声多普勒示分流道内呈高速血流,且有脉冲血流,门静脉内血流速度较低。选择性肝动脉造影和栓塞是诊断和治疗肝动脉损伤的惟一方法。
14.4 4.急性心包填塞
较为罕见,多与操作不当有关。Rups-100导管装置进入下腔静脉时损伤右心房,致心包内积血而出现急性心包填塞症状。正确使用Rups-100导管装置是预防这一并发症的关键,导管的运行必须在X线监视下,由导丝引导送入选定目标,盲目运行易导致这一并发症的发生,心包引流是治疗心包填塞的首选方法。
14.5 5.内支撑移位或成角
内支撑抗压强度小,展开不完全或分流道呈锐角,内支撑顺应性差,放置时内支撑易成锐角、塌陷,从而引起分流道急性阻塞和TIPS术后近期食管静脉曲张再出血。一旦发生需行分流道再扩张和重置内支撑。扩张时分流道直径大于内支撑直径或支撑弹性差,内支撑可能会移位到门静脉或右心房,甚至会导致肺动脉梗塞。
14.6 6.肝性脑病
TIPS术后肝性脑病发生率为13%~25%。肝性脑病的发生与年龄、肝功能Child分级、分流道口径和门体压力梯度密切相关,患者年龄>60岁、严重低蛋白血症、既往有肝性脑病史和TIPS术后门体压力梯度<12mmHg患者术后极易发生肝功能衰竭。与传统门体分流术相比,TIPS术后肝性脑病症状轻,易控制,口服乳果糖能有效地预防和治疗肝性脑病。
14.7 7.肝功能衰竭
TIPS术后肝功能衰竭是由于肝脏缺血性损害所致,术前须认真评估患者肝功能和肝动脉血流状况。如患者术前存在胆红素和转氨酶显著增高、PT显著延长或伴有右心功能衰竭、动脉硬化、腹腔动脉或肝动脉狭窄和阻塞、肝动脉功能不全和肝内动静脉瘘,TIPS术后极易发生肝功能衰竭,其预后极差。近年来,有学者报道采用缩减性内支撑治疗TIPS术后肝功能衰竭,缩减性内支撑能促使内支撑和分流道形成血栓,减少42%的分流道血流,改善肝功能,控制肝损害的进一步发展。
14.8 8.溶血性黄疸
TIPS术后溶血性黄疸发生率约为1%~10%。临床表现为贫血、网状红细胞增多、间接胆红素浓度增高和结合珠蛋白降低。肝脏超声或CT可排除肝内或外周血肿等导致间接胆红素增高的因素。TIPS术后溶血性黄疸与心脏机械瓣膜术后的溶血性黄疸相似,肝内分流道内高流速血流产生的应切力导致红细胞损伤,从而出现黄疸。肝硬化患者红细胞结构和功能异常,同时伴有脾功能亢进,红细胞寿命短,严重肝硬化患者还存在红细胞膜胆固醇代谢和胆固醇/磷酸脂比例异常,破坏了红细胞膜的结构和流变性。因而,高流速异常红细胞在通过支撑棱网孔时易遭受损害,红细胞结构和功能异常是TIPS术后溶血性黄疸的易感因素。TIPS术后溶血性黄疸常为自限性,无需特殊治疗,分流道内膜形成降低血流的应切力和内支撑对红细胞的损伤,术后12~15周黄疸可以缓解。
14.9 9.分流道狭窄和阻塞
分流道狭窄和阻塞是TIPS术存在的主要问题,严重影响TIPS的中远期疗效。术后1年分流道的狭窄和阻塞率为31%~80%,部分患者表现为呕血和腹水复发。引起分流道狭窄和阻塞的因素包括急性血栓形成、内支撑展开不全、分流道内膜过度增生,其中分流道内急性血栓和内支撑展开不全导致早期分流道阻塞,而分流道内膜高度增生导致后期分流道狭窄和阻塞。观察分流道的组织病理改变有助于探讨内膜增生的发生机制。分流道内膜增生可能与下列因素有关:①支撑内壁血小板进行性聚集和血栓机化;②扩张肝实质时细小胆管损伤和胆汁外溢导致局限性炎症;③血小板活化因子激活平滑肌细胞移行为假性内膜;④分流道内高速的血流形成的应切力。分流道狭窄多位于肝静脉段,其次是分流道内。下列指标可作为分流道狭窄或阻塞的诊断标准:①分流道血流速度<50cm/s或分流道直径<50%;②分流道血流量<1000ml/L;③门静脉血流速度<20cm/s或<TIPS术后门静脉血流速度增加的50%;④门体压力梯度>12~15mmHg。根据分流道和门静脉血流速度,超声多普勒诊断分流道狭窄或阻塞的特异性、敏感性和预测性分别为100%、98%和90%。TIPS术后定期超声多普勒随访是诊断分流道狭窄和阻塞的首选方法,特别应加强术后第1年的随访,根据分流道和门静脉血流的动态变化可获得早期诊断。一旦症状复发或超声多普勒诊断分流道狭窄和阻塞,需行直接门静脉造影进一步明确诊断。支撑内局部抗凝能有效预防早期分流道血栓形成,抑制血小板聚集和血小板激活生长因子的药物能显著减少分流道狭窄率,分流道内球囊成形术、再置内支撑、腔内内膜切削术和溶栓等治疗方法可延长分流道的通畅时间。再治疗后1、2年分流道通畅率为80%~90%。