3 概述
阿米巴痢疾(amebic dysentery)是由致病性溶组织内阿米巴(entamoeba histolytica)侵入结肠壁后所致的以痢疾症状为主的消化道传染病,常称为肠阿米巴病或阿米巴结肠炎。病变多在回盲部结肠,易复发变为慢性。原虫亦可由肠壁经血流—淋巴或直接迁徙至肝、肺、脑等脏器成为肠外阿米巴病,尤以阿米巴肝脓肿最为多见。潜伏期一般为1~2周,可短至4天,长达1年以上。阿米巴痢疾预后一般良好。有肠道加杂症和治疗不彻底者都易复发。暴发型患者预后较差,有严重肠出血、肠穿孔、弥漫性腹膜炎等合并症者预后不良。
9 流行病学
阿米巴痢疾见于全世界各地,其感染率的高低是同各地环境卫生和居民营养状况等关系极大。在良好的环境条件和营养状况下,感染率在2%~5%之间,在不良环境卫生条件和营养状况下,感染率可高达50%。近来证实溶组织内阿米巴和迪斯帕内阿米巴是形态上相似的虫种,但具完全不同的生理和病理特征。迪斯帕内阿米巴在肠道中生存的现象比溶组织内阿米巴常见得多,但只有溶组织内阿米巴才是阿米巴病的病原体,因而,过去调查的感染率不准确。据报告世界上约有5000万人感染溶组织内阿米巴,而迪斯帕内阿米巴感染人数却为4.5亿。国内1988~1992年调查溶组织内阿米巴全国平均感染率为0.949%,估计全国感染人数为1069万,感染率超过1%的共有12个省,其中西藏、云南、新疆、贵州及甘肃五个省或自治区感染率超过2%,西藏感染率最高,达8.1243%。
9.1 传染源
慢性患者、恢复期患者及健康排包囊者为本病的传染源。急性患者,当其粪便中仅排出滋养体,不是传染源。溶组织内阿米巴虽可以寄生于猴、野鼠、犬、猪等,但传播至人的机会极少,故作为贮存宿主的证据还不具备。苍蝇、蟑螂体内可以携带包囊,并随粪便排出,仅起到媒介作用,不是中间宿主。从事饮食工作人员,如属排包囊者,其所起的传播作用十分重要。
9.2 传播途径
包囊在土壤中可以生存8天以上;在潮湿及阴凉环境内,如粪便中可以生存几个星期。包囊可以通过污染饮水、食物、蔬菜等进入人体。在卫生环境恶劣的地方,水源或食物易被粪便所污染。在以粪便作肥料地区,未洗净、未煮熟的蔬菜是重要的传播因素。蝇类及蟑螂都可接触粪便,其体表携带和呕吐排便,将包囊污染食物而成为重要传播媒介。犬及猫都能被感染,但不排出包囊,不会起传播作用。在环境卫生极差的情况下,尤其在集体单位,如幼托机构、监狱等处,人与人直接接触传播亦可发生。
9.3 流行特征
溶组织内阿米巴病在热带、亚热带、温带地区发病较多,以秋季为多,夏季次之。发病率农村高于城市,男子多于女子,成年多于儿童,幼儿患者很少。可能与吞食含包囊食物机会的多少有关。新生儿患病也并非不可能,据报道最幼者为出生2天。30岁以后的发病率较低,可能与年龄免疫有关。本病大多为散发,在环境卫生及管理不良的集体单位中可以酿成流行,有报道因水源受到严重污染而发生暴发。
10 病原学
我国古代医籍如《内经素问》、《诸病源候论》等都写述下痢、疫痢等疾病,其中包括阿米巴痢疾。但对于阿米巴病原体的认识,则始于19世纪中叶。Lambl(1859)首先从腹泻大便中见到活动阿米巴。Losch(1875)自慢性痢疾患者粪便中发现含有红细胞的阿米巴,在该例尸检中又发现其大肠有溃疡病变,并在溃疡处亦检得同样的阿米巴;用含有阿米巴的粪便经口服或经肛灌作狗的实验,亦产生同样症状与病变。Koch(1881年)和Kanulis(1886年)进一步确定了本病的病原学。Kartulis(1887年)自肝脓肿中找到阿米巴,Schaudin(1903年)将这种致痢疾的原虫命名为溶组织内阿米巴,并初步描述了该原虫的生活史和形态。早在1928年Brumpt就提出了溶组织内阿米巴有两个种,一种为人类侵袭性阿米巴,另一种为非侵袭性阿米巴命名为迪斯帕内阿米巴,但两者生活史与形态相似,这一观点被忽视了50年。直至1978~1987年,Sargeanut等将10000个溶组织内阿米巴分离株进行同工酶分析,才发现有致病性酶株群(pathogenic zymodemes)与非致病性酶株群(non-pathogenic zymodemes),后者即为迪斯帕内阿米巴。后又发现两者膜抗原及毒力蛋白存在着明显差异;1991年Clark又比较了两类虫株的核糖体基因(rDNA)限制性内切酶图(限制图)图谱,发现两种虫株截然不同。根据上述三方面的资料,1993年WHO专家会议正式将引起侵入性阿米巴的虫株命名为溶组织内阿米巴(Entamoeba histolytica);而肠腔共栖的阿米巴虫株命名为迪斯帕内阿米巴(Entamoeba dispar)。
痢疾阿米巴(溶组织阿米巴,Amoeba histolytica)为人体唯一致病性阿米巴,在人体组织及粪便中有大滋养体、小滋养体和包囊三种形态。滋养体在体外抵抗力薄弱,易死亡。包囊对外界抵抗力强。
10.1 滋养体
大滋养体20~40μm大小,依靠伪足作一定方向移动,见于急性期患者的粪便或肠壁组织中,吞噬组织和红细胞,故又称组织型滋养体。小滋养体6~20μm大小,伪足少,以宿主肠液、细菌、真菌为食,不吞噬红细胞,亦称肠腔型滋养体。当宿主健康状况下降,则分泌溶组织酶,加之自身运动而侵入肠粘膜下层,变成大滋养体;当肠腔条件改变不利于其活动时变为包囊前期,再变成包囊。滋养体在传播上无重要意义。
10.2 包囊
多见于隐性感染者及慢性患者粪便中,呈圆形、5~20μm大小,成熟包囊具有4个核,是溶组织阿米巴的感染型,具有传染性。包囊对外界抵抗力较强,于粪便中存活至少2周,水中5周,冰箱中2个月,对化学消毒剂抵抗力较强,能耐受0.2%过锰酸钾数日,普通饮水消毒的氯浓度对其无杀灭作用,但对热(50℃)和干燥很敏感。
11 病因
溶组织内阿米巴有滋养体及包囊两期。滋养体以往将其分为小滋养体与大滋养体,前者寄生于肠腔中,称为肠腔共栖型滋养体,在某种因素影响下,可使其侵入肠壁,吞噬红细胞转变为后者,称为组织型滋养体。近年来,分子分类学研究证实,两类虫株的基因型和表现型各具有明显的特异性。1993年世界卫生组织根据其同工酶谱、膜抗原与毒力蛋白及编码基因存在的明显差异,正式将非致病性虫株命名为迪斯帕内阿米巴(Entamoeba dispar),而将致病性虫株仍称为溶组织内阿米巴(Entamoeba histolytica)。因此,认为存在肠腔的大部分滋养体为迪斯帕内阿米巴滋养体,为肠腔共栖生物,并不侵入肠壁。而溶组织内阿米巴的滋养体不论其大小,均具有侵袭性,随时可吞噬红细胞,故将这种吞噬红细胞或不吞噬红细胞的溶组织内阿米巴滋养体均称为滋养体。滋养体在患者新鲜黏液血便或肝脓肿穿刺液中,均活动活泼,5μm/s,以二分裂法增生,形态变化较大。当其在有症状病人组织中,常含有摄入的红细胞,大小常在20~40μm,甚至50μm,但在肠腔非腹泻粪便中或有菌培养基中,则大小为10~30μm,不含红细胞。滋养体内、外质分界极为明显,借助单一定向的伪足运动。内质内有一个泡状核,呈球形,直径4~7μm,核膜边缘有单层均匀分布、大小一致的核周染色质粒(chromatin granule)。核仁小(仅0.5μm),常居中,周围为纤细丝状结构。包囊是滋养体在肠腔内形成,但在肠腔以外的脏器或外界不能成囊。在肠腔内滋养体逐渐缩小,停止活动,变成近似球形的包囊前期,以后变成一核包囊,并进行二分裂增生,发育成为四个核的成熟包囊,直径为10~16μm,壁厚125~150nm。溶组织内阿米巴滋养体的形态,通过扫描电镜或透视电镜的观察,发现其细胞膜厚约10nm,外皮为一层绒毛状的糖萼(glycocalyx),胞质内含有无数糖原颗粒和螺旋状排列的核糖体,无典型的线粒体、粗面内质网和高尔基复合体。滋养体表膜上分布有许多丝状突起,有直径0.2~0.4μm圆形的孔,与微胞饮作用(micropinocytosis)有关,在伪足和微饮管口则无这类小孔,此为溶组织内阿米巴滋养体的特征之一。溶组织内阿米巴的体外培养已从单种培养(xenic cultivation)进入单栖培养(monoxenic cultivation),现已发展到纯性培养(axenic cultivation)及近在软琼脂培养基中的克隆化培养。无生物培养的成功,提供了对阿米巴深入研究的条件,解决了纯抗原的制备问题。
12 发病机制
包囊被吞食后,包囊内的核分裂继续进行,在进入小肠下段,滋养体脱囊逸出,随粪便下降,寄生于盲肠、结肠、直肠等部位的肠腔。以肠腔内细菌及浅表上皮细胞为食。在多种因素的作用下,滋养体侵袭肠黏膜,造成溃疡,到一定范围和程度时,酿成痢疾。一般认为溶组织内阿米巴的致病性因素中,有三种致病因子已在分子水平广泛研究和阐明:①分子量为260×103半乳糖乙酰氨基半乳糖(Gal/GalNAC)凝集素(由分子量为170×103和35×103的亚单位通过二硫键连接组成的异二聚体)介导吸附于宿主细胞(结肠上皮细胞、中性粒细胞和红细胞)表面,吸附后还具有溶细胞作用;②阿米巴穿孔素(amoeba perforin)是滋养体胞质颗粒中的小分子蛋白家族,当滋养体与靶细胞接触时或侵入组织时就会注入穿孔素,造成宿主细胞形成离子通道的孔状破坏;③半胱氨酸蛋白酶是虫体最丰富的蛋白酶,其分子量为30×103,可使靶细胞溶解,并有降解补体C3为C3a,而阻止补体介导的抗炎反应。阿米巴滋养体不仅能吞食红细胞,并且有迅速触杀白细胞的能力,这种触杀力的强弱,可以作为判断虫株毒力的指标。宿主的健康状况及滋养体的毒力程度可能与造成病变有关,滋养体的毒力并非固定不变的,可以通过动物传代而增强,也可在多次人工培养后而减弱。某些革兰阴性菌可以增强滋养体的毒力,如产气荚膜杆菌等可以明显增强实验动物感染率和病变程度。
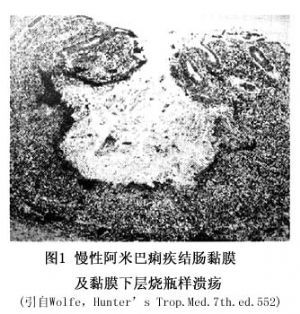
阿米巴痢疾的病变部位多发生于盲肠或阑尾,也易累及升结肠、乙状结肠及直肠,偶及回肠下段。病变以局限性黏膜下小脓肿开始,其孤立散在分布。组织破坏逐步向纵深发展,自黏膜下层直至肌层,形成口小底大的典型烧瓶样溃疡(图1)。早期病变仅可见黏膜小溃疡,表面周围略上翻,但边缘不整齐,溃疡表面可见深黄色或灰黑色坏死组织,在其深部可找到滋养体。溃疡与溃疡之间的黏膜一般正常,如无继发细菌感染,则无炎症反应。但由于黏膜下组织较为疏松,故滋养体可顺长轴向两侧扩展,使大量组织溶解而形成多窦道相通的蜂窝状区域。溃疡底部的血管有血栓形成,但有时病变可破坏小动脉酿成严重甚至危及生命的出血。溃疡亦可穿破肌层直至肠壁,使后者变得极薄,肠内容可以渗漏至腹腔,或穿破肠壁,造成局限性腹腔脓肿或弥漫性腹膜炎。滋养体也可进入门静脉血流,在肝内形成脓肿,且可以栓子形式流入肺、脑、脾等组织与器官,形成脓肿。在慢性病变中,息肉样残片可伸向肠腔。溃疡愈合后仍可见到瘢痕痕迹。由于滋养体反复侵入黏膜,加以细菌继发感染,致使肠黏膜组织对阿米巴刺激的增生反应,伴慢性炎症和纤维化,可出现大块状肉芽肿,成为阿米巴瘤(amoeboma),多见于盲肠、横结肠、肛门直肠交接处,质硬,难以与大肠癌相鉴别。病变在显微镜下所见,组织坏死伴少量的炎症细胞,以淋巴细胞和浆细胞浸润为主,由于滋养体可溶解中性粒细胞,一般中性粒细胞极少见,但有细菌继发感染时,仍可见到较多中性粒细胞。阿米巴滋养体满布于整个病损中,尤其多见于病损扩展的边缘,甚至在邻近的正常组织中也有存在。
13 阿米巴痢疾的临床表现
潜伏期一般为1~2周,可短至4天,长达1年以上。起病突然或隐匿,可有以下临床类型。
13.1 无症状型(原虫携带状态)
大多数粪便内能找到阿米巴原虫而无症状,包囊仅在常规粪检中发现,并在整个感染期间排出,作为共居者存在,不侵袭组织,这类患者约90%为迪斯帕内阿米巴感染。但也有极少数感染溶组织内阿米巴而症状不明显,多年保持亚临床状态如腹部不适、气胀、便秘等。
13.2 普通型
起病一般缓慢,有腹部不适,大便稀薄,有时腹泻,每天数次,有时亦可便秘。腹泻时大便略有脓血,呈痢疾样。如病变发展,痢疾样大便可增至10~15次/d或以上,伴有里急后重,腹痛加剧和腹胀。回盲部、横结肠及直肠部均可有压痛。全身症状较轻微,常有低热或不发热。上述症状一般持续数天至数星期,可自行缓解,如未接受治疗则易于复发。粪检可有少量或多量滋养体,大便有腐败腥臭。
13.3 暴发型
此型少见,多发生于体弱和营养不良者。起病急骤,中毒症状显著,重病容,有高热及极度衰竭。大便迅速增至15次/d以上,含明显脓血与大量滋养体,甚至肛门失禁,呈水样或血水样,有奇臭,伴呕吐、剧烈腹痛、里急后重及腹部明显压痛。患者有不同程度脱水与电解质紊乱,有时可出现休克,易并发肠出血与肠穿孔。如不积极抢救,可于1~2周内因毒血症或并发症而死亡。
13.4 慢性型
常为普通型未经彻底治疗的延续,病程可持续数月甚至数年不愈。腹泻反复发作,或与便秘交替出现。一般腹泻每天不超过3~5次,大便呈黄糊状,带少量黏液及血液,有腐臭,常伴有脐周或下腹部疼痛。症状可持续存在,或有间歇。间歇期长短不一,可为数星期或数月。间歇期间可无任何症状,常因疲劳、饮食不当、暴饮暴食及情绪变化等为复发的诱因。久病者常伴有贫血、乏力、消瘦、肝大及神经衰弱等。易并发阑尾炎及肝脓肿。大便检查可找到滋养体或包囊。
14 阿米巴痢疾的并发症
14.1 肠内合并症
(1)肠出血:深溃疡可侵蚀血管引起程度不等的肠出血,有时成为本病的主要症状。大量出血少见。
(2)肠穿孔:多发生于暴发型及有深溃疡的患者,穿孔部位以盲肠、阑尾和升结肠为多见,穿孔后可引起局限性或弥漫性腹膜炎。急性穿孔较少见,慢性穿孔较多,大多无剧烈的腹痛发作,穿孔发生的时间常难以确定,但全身情况逐渐恶化。X线检查可见游离气体而确诊。有时由于先形成粘连,穿孔后可形成局部脓肿,或穿入附近器官而形成内瘘。
(3)阿米巴性阑尾炎:盲肠部病变易蔓延至阑尾。临床症状与一般阑尾炎相似,但易发生穿孔。据称热带、亚热带地区因阑尾炎而手术者,发现约1/3为阿米巴感染所致。
(4)结肠肉芽肿:慢性病例由于黏膜增生,发生肉芽肿,形成大肿块,极似肿瘤,称为阿米巴瘤,极易误诊为肠癌。多见于盲肠、乙状结肠及直肠等处。
14.2 肠外合并症
溶组织内阿米巴滋养体可自肠壁静脉、淋巴管或直接蔓延,播散至肝、腹腔、肺、胸膜、心包、脑、泌尿生殖道或邻近皮肤,形成脓肿或溃疡,其中以阿米巴肝脓肿最常见。
15 诊断
典型阿米巴痢疾诊断不难,确诊有赖于粪便中找到病原体。不典型病例往往需借助结肠镜检查、血清学检查及诊断性治疗等措施。
15.1 流行病学史
流行地区、卫生条件差的人群为主[1]。
15.2 临床症状
一般起病较慢,中毒症状较轻,痢疾样腹泻次数较少,有果酱样大便,容易反复发作。由于其症状轻重不一,且缺少特征性,故对慢性腹泻或有含糊不清的肠道疾病者,应考虑有本病可能。
阿米巴痢疾起病缓慢,以腹痛腹泻为主,腹泻次数为每日10次左右,腹泻粪质较多,典型大便呈果酱样,带有血和黏液,有腐败腥臭味;体检发现有下腹压痛。轻症和慢性患者症状不典型,重症(暴发性阿米巴痢疾)则发病急,以高热、感染中毒症状开始起病,大便次数多,呈血水样,奇臭,可有感染中毒休克表现[1]。
15.3 实验室检查
粪便检查是确诊的重要依据。发现病原体后尚须鉴别非致病性阿米巴原虫。目前血清学检查发展很快,是诊断阿米巴病的关键性实验,大约有90%的患者血清,可通过ELISA、间接血凝及间接免疫荧光等检测不同滴度的抗体。PCR诊断技术为十分有效、敏感及特异的方法。WHO专门委员会建议,镜下检获含四核的包囊,应鉴定为溶组织内阿米巴或迪斯帕内阿米巴;粪中检测含红细胞的滋养体,应高度怀疑为溶组织内阿米巴;血清学检查高滴度阳性,应高度怀疑为溶组织内阿米巴感染。阿米巴病仅由溶组织内阿米巴引起。
阿米巴痢疾典型大便呈果酱色,腥臭,镜检可发现变形红细胞和少量白细胞,可找到吞噬细胞;血常规大多正常,但暴发性阿米巴痢疾患者白细胞增高,中性粒细胞比例增加[1]。
阿米巴痢疾患者大便中可找到阿米巴滋养体,排包囊者可以找到阿米巴包囊;原虫抗原检查在部分地区实验室可以进行[1]。
15.4 结肠镜检查
对那些显微镜检查、血清学及PCR检查均未获阳性结果,而临床高度怀疑的病例,可行结肠镜检查或纤维肠镜检查。约2/3有症状病例中,直肠和乙状结肠黏膜可见大小不等的散在溃疡,表面覆有黄色脓液,边缘略突出,稍充血,溃疡与溃疡之间的黏膜正常。从溃疡面刮取材料作镜检,发现滋养体机会较多。
15.5 X线钡剂灌肠检查
病变部有充盈缺损、痉挛及壅塞现象。此种发现虽无特异性,但有助于阿米巴瘤与肠癌的鉴别。
15.6 诊断性治疗
16 实验室检查
16.1 粪便检查
为确诊的重要依据。典型阿米巴痢疾的粪便呈暗红色果酱样,有特殊的腥臭,粪质较多,含血及黏液。镜检可见大量黏液成团的红细胞和少量白细胞,有时可见活动的、吞噬红细胞的滋养体和夏-雷(Charcot-Leyden)晶体。慢性患者的成形粪便中一般只能检得包囊,可采用硫酸锌离心浮聚法或汞碘醛离心沉淀法或硅石胶态悬浮液(商品名percoll)梯度分离法浓集后,再作碘染色检查包囊,可提高其阳性检出率。粪便标本分离培养原虫,常用Robinson培养基,对亚急性或慢性病例检出率比较高,因其要求条件较高,目前尚不能作为医院诊断的常规检查。检查阿米巴原虫时,应从虫体大小、核的数量、伪足形状及运动方式等方面和其他肠道非致病性原虫,如结肠内阿米巴、哈氏内阿米巴相鉴别。必要时可将包囊或滋养体染色,根据核的结构及拟染色体、糖原泡等加以鉴别。目前已有多种方法可将溶组织内阿米巴与迪斯帕内阿米巴相鉴别,主要包括同工酶分析、酶联免疫吸附试验和PCR法分析。以溶组织内阿米巴表面分子量为260×103Gal/GalNAC凝集素作为靶抗原,以单克隆抗体检测,其在血和粪便中的敏感性和特异性达88%和99%,这种方法目前欧美已有试剂盒出售。PCR法可直接从DNA水平鉴别出两种内阿米巴,其中以检测编码分子量为29×103/30×103多胱氨酸抗原的基因最为特异和可行。据称可直接从粪便PCR法鉴别出两种内阿米巴。
16.2 血清学检查
应用阿米巴纯抗原可以作多种免疫血清学诊断试验。无症状排包囊者抗体检测为阴性,体内有侵袭性病变时才有抗体形成。检测方法有间接血凝(IHA)、间接免疫荧光抗体(IFA)、琼脂扩散法(AGD)及酶联免疫吸附试验(ELISA)等。阿米巴痢疾阳性率可达60%~80%,这种抗体在治疗后可持续存在2~10年,而ELISA抗体滴度在患病后几个月内即可转阴,表明一旦抗体阳性提示急性感染。另外IFA法检测一般在痊愈后半年至1年,其抗体滴度可明显下降或转阴,也可作为诊断手段。目前已应用重组抗原检测抗体,据报道其敏感性和特异性均在90%以上。
16.3 核酸检测
主要提取脓液或粪便培养物、活检的肠组织及脓血便的DNA,以适当的引物进行扩增反应,目前认为按溶组织内阿米巴编码分子量为29×103/30×103多胱氨酸抗原(又称peroxiredoxin)基因设计的引物最为良好的特异性和敏感性。
18 鉴别诊断
阿米巴痢疾需要与其他腹泻性疾病相鉴别,特别是慢性腹泻,如结肠肿瘤、溃疡性结肠炎、慢性细菌性痢疾等[1]。
阿米巴痢疾应与下列疾病相鉴别:
18.1 细菌性痢疾
鉴别要点见表1。

18.2 血吸虫病
有疫水接触史,肝脾大、血嗜酸性粒细胞增高,大便毛蚴孵化、直肠黏膜活检虫卵及环卵沉淀试验或循环抗原检测等阳性可资鉴别。
18.3 结肠癌
一般年龄较大,排便习惯改变并有不畅感。粪便变细且含血液,有渐进性腹胀。肛指检查、X线钡剂、结肠镜检查等有助于鉴别。
18.4 非特异性溃疡性结肠炎
左侧痉挛性疼痛,内镜检查可见结肠黏膜广泛充血、水肿,溃疡多而易出血,多次病原体检查阴性,血清免疫学试验阿米巴抗体阴性,抗阿米巴诊断性治疗无效等可作出诊断。
19 阿米巴痢疾的治疗
19.1 一般治疗
急性期应卧床休息,给予流质或半流质饮食,肠道隔离至症状消失,或大便连续3次找不到滋养体及包囊。暴发型给予输液、输血等支持疗法。慢性型应加强营养,增强体质。
急性期患者注意休息,进食流质少渣饮食;暴发性阿米巴痢疾需要积极补液、纠正水电解质酸碱平衡紊乱,可补充葡萄糖氯化钠、碳酸氢钠等[1]。
19.2 病原治疗
甲硝唑适合于各种类型肠道阿米巴痢疾的治疗,一般成人750mg,口服每日3次,疗程10天;对不能口服患者可静脉滴注甲硝唑治疗,500mg,每12小时1次[1]。
(1)硝基咪唑类:甲硝唑(metronidazole)对阿米巴滋养体有较强的杀灭作用,是目前治疗肠内、外各型阿米巴病的首选药物。本品口服后在小肠内吸收,1h血浆浓度达高峰,半衰期为6~7h。一般治疗剂量为400~800mg/次,3次/d口服,连用5~10天;儿童50mg/(kg·d),分3次服,连用7天。静脉用药以15mg/kg体重,即刻应用,以后7.5mg/kg体重,隔6~8h重复之。副作用轻,以胃肠道反应为主,但在动物实验中发现有潜在致畸性,因而在妊娠3个月以内和哺乳妇女忌用。本品口服吸收良好,结肠浓度偏低,单纯用于杀虫者效果不够理想。替硝唑(tinidazole),本品吸收快,血浓度较甲硝唑高1倍,半衰期较长(10~12h),副作用小,疗效更好。剂量为2g/d,儿童30~40mg/(kg·d),清晨1次口服,连服5天。同类药物尚有奥硝唑(ornidazole)及另丁硝唑(secnidazole),半衰期更长,对各型阿米巴病亦有良好疗效。
(2)依米丁类:依米丁(emetine)对阿米巴滋养体有直接杀灭作用。对组织内滋养体有极高的疗效,但对肠腔阿米巴效果不显著。由于该药毒性较大,治疗量与中毒量较接近,且有蓄积作用,能产生心肌损害,已被其衍生物去氢依米丁(dehydroemetine)所取代,剂量按1mg/(kg·d)计算(成人不超过60mg/a),分2次作深部皮下注射,连用6天。
(3)双碘喹啉(diiodohydroxyquinoline):本品主要作用于肠腔内阿米巴。口服后吸收<10%,肠腔内浓度高。作用机制为螯合亚铁离子,阻断原虫代谢率达60%~70%。本品毒性低,偶有头痛、恶心、皮疹及肛门瘙痒等。成人剂量为0.6g/次,3次/d,儿童30~40mg/(kg·d),15~20天为一个疗程。
(4)二氯尼特(diloxanide furoate):本品是目前最有效的杀包囊药物,可能与阻断蛋白质合成有关。对轻型及带包囊者的疗效为80%~90%,毒性低,仅见腹胀、恶心等轻度副作用。成人剂量为500mg/次,3次/d,连服10天为一疗程。本品不宜用于孕妇患者,因其可能有致畸性。
(5)硝唑尼特(硝噻醋柳胺):本品是一种有效抗肠道原虫药物。据Rossignol等报道对溶组织内阿米巴、贾第鞭毛虫所致的腹泻,500mg/次,2次/d口服,连续3天,经随机、双盲对照观察,效果明显,于治疗后7天内即停止腹泻,副作用较轻。
(6)抗菌药物:主要通过抑制肠道共生细菌而影响阿米巴的生长繁殖,尤其对阿米巴痢疾伴发细菌感染时效果尤佳。如四环素类、氨基糖苷类(如巴龙霉素)及氟喹诺酮类等抗菌药物。为取得最佳疗效,上述药物多采用联合用药,常用的治疗方案如下:①普通型一般采用甲硝唑,其治愈率可达90%,如加用抗菌药物可提高疗效。若有包囊排出,可加用二氯尼特或双碘喹啉。②暴发型可采用甲硝唑静脉内给予,同时与抗菌药物联合,并对症治疗。③慢性型可根据病情轻重,适当选用甲硝唑或双碘喹啉,亦可选用二氯尼特治疗。④无症状型可选用二氯尼特或双碘喹啉。
19.3 纠正慢性化原因
慢性阿米巴痢疾患者除积极病原治疗外,还需要针对其慢性化原因(如合并感染、饮食习惯、器质性肠道病变等),加以纠正[1]。
19.4 合并症治疗
在积极有效的抗阿米巴药物治疗下,一切肠道合并症均可获得缓解。暴发型患者常有合并细菌感染,应加用有效抗生素。大量肠出血者可输血。肠穿孔伴腹膜炎者应在甲硝唑和广谱抗生素控制下进行手术治疗。
24 参考资料
- ^ [1] 国家基本药物临床应用指南和处方集编委会主编.国家基本药物临床应用指南:2012年版[M].北京:人民卫生出版社,2013:49-50.