5 概述
同种异体小肠移植(简称小肠移植)在1964年即开始用于临床,由于当时在移植技术、免疫排斥、感染与肠功能恢复等方面没能很好地解决,阻碍了肠移植进一步在临床的应用,成为大器官移植中成功较晚的一个。1990年,加拿大Grant报道了1例存活1年以上的肝肠联合移植者,并认为肝肠移植后可增加免疫耐受性。其后美国Todo比较了肝肠联合移植与单独小肠移植,却认为后者的技术操作较简单,术后恢复亦较为顺利。文献中虽陆续有成功的病例报道,但迄今(2003年)尚不足千例,进展甚为缓慢。
6 小肠相关解剖
小肠系指胃幽门至盲肠间的肠管,含十二指肠,空肠与回肠。空肠与回肠是小肠的主要部分,通称小肠。空肠与回肠是腹腔中面积最大,高度活动的器官。起始于Treitz韧带(十二指肠空肠曲)盘曲于中腹部与下腹部,部分为大网膜及结肠所覆盖。若患者无腹部手术史,手术时从左上腹取出的小肠多为空肠,从盆腔取出者多半为回肠。空肠与回肠间无明显的分界线,但在结构上有若干区别点(表1.6.5-0-1)。手术时,可借助这些区别点,辨认空、回肠。肠管有一定的伸缩性,故在活体与标本测量的长度不一致。一般测量的结果是空、回肠长6m。现在认为最适合的方法是从鼻放置细聚乙烯管让其自然到达回盲部,测量其长度。用此方法测得空、回肠的长度为2.6m。小肠上部的2/5为空肠,下部3/5为回肠。

小肠系膜甚宽,附着于第2腰椎左侧腹后壁,向右斜行至右骶髂关节之下。肠系膜内含有血管、神经、淋巴管、淋巴结及脂肪。肠系膜附着部能防止扭转,影响循环。手术时,根据系膜的走向能辨别游离肠段的近、远端。肠系膜根部至肠缘的距离在小肠起始部为最短,末端回肠部亦较短,而跨过脊柱的部分为最长,一般不超过20~25cm。
小肠的血供来自上肠系膜动脉,它是腹主动脉的第2个大分支。上肠系膜动脉自胰腺的钩状突部穿出,跨过十二指肠第3段,进入小肠系膜根部,然后分出右结肠动脉,回结肠动脉和10~20个小动脉分支(图1.6.5-0-1)。前2支动脉经腹膜后或系膜根部供应升结肠、盲肠及末端回肠。因此,当肠系膜上动脉损伤或梗死时,随损害部分的高低可引起空肠、回肠、在半结肠或部分空肠、回肠的缺血坏死。

小肠动脉分支位于小肠系膜内,形成吻合网(动脉弓),再由动脉弓分出直支到达肠壁内。小肠上部系膜动脉弓仅一个(初级弓),直支较长,周围脂肪较少,愈向远端小肠动脉弓愈多。由初级弓分出动脉支吻合为2级、3级弓,动脉直支较短(图1.6.5-0-2)。系膜内脂肪亦较多。在肠系膜缘,血管又再分支。肠管壁的血管与环形肌层平行走行,先后穿过浆膜,肌层和黏膜下层。主要的动脉分支与直支被破坏后,这些血管供应的肠管便易发生坏死。

小肠静脉的分布与动脉大致相同。最后汇合成为肠系膜上静脉。它与上动脉并行,在胰颈的后方与脾静脉汇合形成门静脉。肠系膜上静脉损伤或发生栓塞时,也可致小肠静脉充血、坏死和腹膜炎。
小肠肠壁分为浆膜、肌肉和黏膜3层。肌肉又分为外层纵肌和内层环肌。黏膜下层为较强的弹力纤维与结缔组识。不论用哪种方式缝合肠壁,缝线必需通过这一层。
小肠黏膜下层有聚合淋巴结与淋巴板(Peyer’s patches),尤以回肠部为多。小肠部的淋巴流入肠壁、邻近血管弓部与上肠系膜动脉主干部等3个部位的淋巴结,然后进入乳糜池。
小肠的主要生理功能是消化和吸收。除胰液、胆液及胃液等可继续在小肠内起消化作用外,小肠黏膜腺体也能分泌含有多种酶的碱性肠液。其中主要的是多肽酶(肠肽酶)。它能将多肽变为可由肠黏膜吸收的氨基酸。食糜在小肠内分解为葡萄糖、氨基酸、脂肪酸后,即被小肠黏膜吸收。小肠黏膜上有很多绒毛。每一个绒毛被柱状上皮细胞多层覆盖,含有一个毛细血管襻和淋巴管(乳糜管),因而使吸收面积大为增加,构成近10万m2的吸收面积。葡萄糖、氨基酸及40%脂肪酸系由毛细血管吸收,经过门静脉到达肝内。其余60%脂肪酸则由乳糜管吸收,到达乳糜池及胸导管内。除食物外,胃液、胆液、胰液,肠液内的电解质,以及摄入的大量电解质也在小肠内被吸收进入血液循环。小肠被大量切除后,营养的吸收将受到影响。吸收最差的是脂肪,其次是蛋白质。碳水化合物是易被吸收的营养物质。根据临床实践,空肠与回肠保留100cm以上,并有回盲部,经过机体的代偿,仍能维持营养的消化,吸收。末段回肠对蛋白质、脂肪、碳水化合物有良好的吸收功能,并具有对某些微量物质(铜、维生素B12)与胆汁的特定吸收功能。因此,大量小肠切除后,虽然切除的长度相当,但营养不良在回肠被切除的病例较为明显。
小肠是产生免疫球蛋白的场所,特别是IgA。一般认为它由laminal propria的血浆细胞产生。
小肠也可以产生缩胆素(cholecys tokinin)、促胰酶素(pancreozymin)、肠高糖素(enteroglucagon)、肠血管活性肽(VIP vasoactive intestinal peptide)、胃抑制多肽(GIP gastric inhibitory polypetide)、生长抑素(somatostatin)等物质。这些物质直接影响消化系统其他器官如胆囊、胰腺等的功能。
肠黏膜尚具有屏障功能,能阻挡肠腔内细菌、毒素越过肠壁进入淋巴系统或门静脉内。
小肠由自主神经系统支配。交感神经纤维自第9、第10脊髓节分出,进入上肠系膜神经节。节后神经伴随肠系膜上动脉进入小肠。副交感神经节前纤维通过迷走神经与肠内神经丛的神经元相接。刺激副交感神经,则增加肠管之张力和运动及肠腺分泌。刺激交感神经,则肠管之张力松弛,运动受抑制,且血管收缩。肠内神经包括肠肌内Auerbach神经丛和黏膜下Meissner神经丛两部分。刺激肠肌丛部分使肠管平滑肌收缩,刺激黏膜下丛部分抑制平滑肌。
小肠的肌肉有节段性收缩和蠕动两种运动型式。前者是局部周径收缩。上段小肠每分钟约收缩9次,远段小肠每分钟收缩11次。这一动作使肠内容物得到搅拌,使之与更大范围的黏膜相接触。蠕动为小肠自上而下的收缩,每分钟1或2次,1次数厘米。在消化吸收过程,小肠有自上而下的环形收缩,起自胃或十二指肠,每分钟推移6~8cm,每次持续4~5min。小肠的运动受肌浆蛋白因子(myogentic factor)、神经原性因子(neurogenic factor)与内分泌因子(hormonal factors)的调控。
综上所述,小肠是人体吸收营养的主要器官,它具有极其强大的代偿功能。尽管如此,外科医师在处理小肠病变时,仍应考虑到这些功能的重要性,要尽量保留可保留的肠管。
7 适应症
小肠移植被认为是治疗不可逆转肠衰竭的合理方法,肠衰竭是指那些病人的肠道因解剖或功能的关系而不能维持机体最低的营养需要甚至水、电解质的平衡。它包含短肠综合征、广泛慢性炎性肠道疾病、严重系膜血管疾病,肠神经、肌肉以及先天性肠道畸形。
9 术前准备
1.供肠的准备。供体在术前可以给予免疫抑制剂如环孢素A(CsA)、FK506等。肠道可作准备,应用缓泻剂与抗生素以清除肠内容物,还可给予足量肝素以防血凝。但从非脑死亡供体获得供肠时难以做到这些准备。
2.免疫抑制剂的应用。受体在术前宜先接受免疫抑制剂治疗,CsA,FK506可在术前1~2d给予。肠道也做清洁、抑菌的准备。营养不良者应先做术前营养支持。手术日,在手术开始时给予预防性广谱抗生素,手术开始后给予大剂量甲泼尼龙500~1000mg静注持续滴入;CSA或FK506等亦在手术开始时给予。CsA为静注6mg/(kg·d)(静脉注射剂的药效3倍于口服制剂),亦有给予前列腺素E10.6μg/(kg·min)或ATG(Anti thymoglobulin),OKTs等。当前,可采取FK506或CsA与甲泼尼龙,骁悉、赛尼哌(人源化IL2受体阻断剂)联合。所有免疫抑制剂应根据血药浓度与病人的体征、症状与肝肾功能进行调整。
3.防治感染。在免疫抑制剂应用的情况下,器官移植病人的感染发生率甚高,抗感染的要点是防止感染,一切操作严格按无菌技术要求进行,加强消毒隔离制度,应用广谱抗生素。
4.促进肠功能的恢复。肠移植的目的是建立一个能维持机体营养需要与其他功用的新肠襻。无疑,维持营养是最主要的。营养的吸收功能涉及到很多方面,其中最主要的是肠黏膜形态和功能的恢复。促进供肠黏膜在形态与功能方面的恢复是肠移植后着重处理的核心问题。肠黏膜是耐受缺血能力尤其是热缺血较差的一种组织。在我国,从尸体获得供肠尚不能完全避免热缺血。为此要设法使供肠的黏膜及早渡过退化、再生恢复到正常的过程。经过一可耐受的热缺血(<6min)和总缺血时间(<17hr)后吸收功能有变化,术后2周内其吸收功能明显受损,4周时才开始恢复。显示有一个由炎症退变到修复再生至正常的过程,历时约2个月。缺血时间越长,其功能恢复缓慢甚至不能恢复。故在术中要求尽量缩短热缺血与恢复血循环的时间。木糖吸收试验是当前检测肠吸收功能的有效方法。在肠功能未恢复前,肠外营养是主要的营养途径,待肠内营养开始后即可缓慢撤去肠外营养至肠内营养能完全供给营养时为止。理论上,谷氨酰胺是肠黏膜所必需的组织营养素,它能帮助肠黏膜的修复,当肠蠕动恢复后即可从高位空肠造口缓慢灌入,早期氨基酸的吸收较葡萄糖、脂肪为好,以氨基酸为氮源的肠道制剂较合适。食糜能刺激黏膜绒毛的再生,及时给予口服饮食甚为必要。
肠道营养可促进肠黏膜细胞的增生,有利于维护肠黏膜屏障功能,当肠黏膜屏障功能发生障碍时,易有肠细菌易生,导致全身性炎症反应、脓毒症,也为诱发排斥反应的发生。
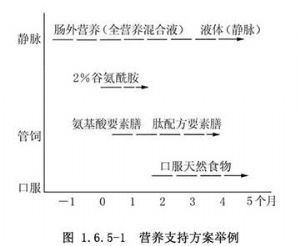
从营养支持方案举例(图1.6.5-1)中可以看出,营养支持的梗概。
11 手术步骤
小肠移植尚不是定性的手术,它可以是单一的小肠移植,也可以是与其他器官的联合移植,最常见的是肝肠联合移植,由于长期应用肠外营养,导致肝脏损害至衰竭,文献中报道的肠移植与肝胆联合移植的数量相等。
如同其他器官移植一样,整个手术可分为供体手术、受体手术与围手术期处理3部分。现就单独小肠移植作一介绍。
11.1 1.供体手术
理想的供体应是年龄相似,体型相似,同性别,以便移植肠容积、长短、血管的口径与宿主相同。要求血型相同,最好做HLA配型和淋巴毒试验。但是,在当前供体有困难的条件下采用非脑死亡供体时,难以如此要求,然血型必须相同。
(1)为缩短热缺血时间,获取供肠时,手术组应紧密配合动作迅速。先向供体腹壁倾倒大量碘伏消毒皮肤,做“十”字大切口(图1.6.5-2),进腹腔后立即放入大量无菌碎冰块(图1.6.5-3)。

(2)分离出髂动脉分叉上腹主动脉,结扎下端,立即插入导管灌入4℃林格液1000ml压力为120cmH2O后再灌入UW液(威斯康汀大学溶液)(图1.6.5-4)。

(3)在膈下结扎阻断腹主动脉,使灌注液逆行注入肠系膜上动脉(SMA)。然后沿右结肠及左结肠旁沟切开后腹膜,将整个肠襻、脾、胰、十二指肠、胃一并掀起。在肝门部钳夹切断肝、十二指肠韧带,也钳夹切断两侧肾血管,切断上肠系膜动脉段上下的主动脉与下腔静脉,以血管钳封闭幽门下十二指肠及回肠并切断。将整个小肠、胰、脾等取出浸泡在4℃UW液中,并从主动脉段再插入导管,灌入UW液约1000ml,要求在短暂的时间内完成肠系膜血管床的灌洗,小肠及其肠系膜应无血色,完成整个小肠及附近器官的获取,一般约需10min。将供肠等转送至手术室做进一步处理。分离出SMA在开口部带有Carrel主动脉片,肠系膜上静脉(SMV)分离到门静脉部,注意防止血管骨骼化,但旁支及周围组织应清除干净(图1.6.5-5)。

(4)切断的肠系膜缘血管应妥善止血。切除胰腺、十二指肠及空肠近端、回肠远端各50cm,剩下小肠3~4m。敞开肠管的两端,以4℃含卡那霉素2g的0.5%甲硝唑100ml溶液做肠腔内灌注,并可灌注UW液。
在修整供肠的整个过程应浸泡在4℃UW液中进行,并注意保持液体的温度在4℃,严格按无菌技术操作。
11.2 2.受体手术
根据病人腹内病变的复杂程度,在供体整理前数小时或同时开始手术,一般要求受体的移植床应在供体整理妥善前完成,以缩短供体的缺血时间。不可让整理好的供肠等待受体床的准备。
按要求选择切口,多数采用腹正中长切口,便于向上、下、左、右延伸。进腹后首先将需要切除的肠襻清除。除MSV有栓塞者外,应注意显露与保护肠系膜上静脉的残留部分,观察静脉的粗细及残留长度,考虑是否可留做吻合用,然后再考虑其他步骤。
在选择小肠移植的手术方式时主要考虑的是肠系膜静脉回流;供肠的长度;供肠与受体肠的吻合是一期完成还是分期完成等问题。
肠系膜静脉的回流:通常移植肠只有动脉与静脉两根主要的血管要进行吻合,动脉的吻合仅考虑吻合的位置要合适,操作方便,保证有充足的血供即可。静脉的吻合部则要考虑是门静脉系统还是体静脉系统,后者如髂总血管,显露方便,位置浅。在技术操作上无大困难,有如肾异位移植。但其主要缺点是肠系膜血流直接返回体静脉系统,反流血中的营养素及某些因子不能直接进入肝脏,对肝脏与营养都不利,且肠系膜静脉血中含有大量的氨,直接进入到体静脉系统后易引起高氨血症。因此大多数学者主张肠系膜静脉血宜反流至门脉系统进肝。为此,供肠系膜的血管与宿主的血管吻合通常有下列4种形式:
①供肠肠系膜上动脉、静脉分别与宿主的髂总动脉、髂总静脉或是腹主动脉,下腔静脉吻合(图1.6.5-6)。静脉血流直接返回至体静脉系统。

②供肠MSV与宿主MSV做对端或端-侧吻合,根据宿主的MSV口径而定。供肠MSA与宿主肾动脉平面下腹主动脉端-侧吻合,只要宿主的MSV能用于吻合,这一术式操作不困难,静脉反流合理,较多被采用(图1.6.5-7)。

③供肠MSV与宿主的门静脉做端-侧吻合,MSA与宿主的腹主动脉做端-侧吻合。这一术式用于宿主的MSV不适合做吻合时用。静脉的反流通畅,直接进门静脉是其优点,但需将整个胰、十二指肠向内掀起,操作范围稍大,MSA相应地要吻合在较高的腹主动脉平面上,增加了操作的难度(图1.6.5-8)。

④在少数情况下,将宿主的脾切除,供肠的MSA、MSV与脾动、静脉断端做对端吻合。动物实验与临床应用均有这种术式,缺点是脾动脉、静脉口径较小,血循环量不足,也易有吻合口狭窄。尤不适用于成年人(图1.6.5-9)。

不论吻合在何部位,均应考虑到宿主血管吻合口与血管本身管径,是否能有足够的动脉血供应,静脉能否使血流及时反流而不致淤血,通常应以供体MSV与MSA的管径为准。血管吻合以5-0高分子线连续外翻吻合,术时注意防止血栓的形成,并尽量避免漏血、补针。吻合时,一般宜先吻合静脉,在吻合血管时,从动脉置管灌注4℃血浆,将供肠血管内的UW保存液排除出血管不致返回至受体循环系统。由于全肠管约可灌入1400~1800ml血液,因此,开放循环前应通知麻醉师,预先补充血容量,以免骤然出现低血容量的现象。术后是否应用抗凝剂应根据手术野创伤的范围与渗血程度,病人的凝血情况而定,通常在血容量充足,吻合口操作满意时,一般都不需在术后应用抗凝剂。
供肠的长度:它曾是一个讨论较多的问题,长度愈长,其中所含的淋巴组织愈多,可能排异越重。且有时是由活体供肠,长度的切取有一定的限度。但是,移植肠的长度术后要能维持营养,供肠的功能是否能全部恢复也值得加以考虑,同时现在的临床经验也不足,究竟以多长为合适,尚无定论。有报道活体供肠仅长60cm者,而尸体供肠多是全小肠移植。早期报道的病例,都以小肠移植为主,但在无结肠的病人,术后常有腹泻加重的情况。因此,在无结肠的病人可与小肠一并移植回盲部、盲肠、升结肠,或更多的结肠,有利于液体的吸收减少腹泻,但增加了细菌易位、感染的危险。多数作者多不赞同移植结肠。
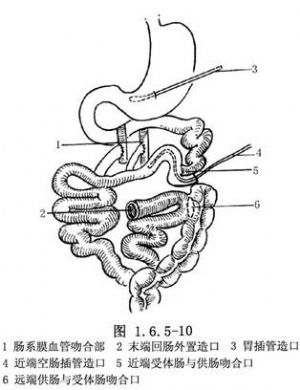
一期或二期完成肠吻合:动物实验时多采用二期完成移植。一期手术时先吻合动静脉,供肠两断端暂时外置有利于观察及实验研究用,其后,待肯定供肠成活后再二期手术将供肠与受体肠吻合完成移植。临床上虽也有灌食与观察的需要,但如采用二期手术,尤其在已经应用较多的免疫抑制剂及肾上腺皮质激素后,对控制感染与切口愈合都将有影响。因此,现在多采用一期完成供肠与宿主肠的吻合。但为肠道灌食,可在近端做肠插管造口,供肠远端与宿主肠做侧-端或侧-侧吻合后,再将末端提出外置造口做观察窗用(图1.6.5-10)。末端回肠造口可在急性排斥的易发期后,吸收情况有好转的情况下复位关闭,一般在移植后6个月左右进行。
12 术后处理
同种异体小肠移植术后做如下处理:
在术后早期应用全肠外营养的基础上即开始从肠道灌入谷氨酰胺液以促进受损害肠黏膜的恢复,待肠功能有所改善时加灌以结晶氨基酸组成的要素膳,因氨基酸较易被吸收,其后改为肽配方的要素膳以有利于肠黏膜功能的恢复,根据肠吸收的情况增加口服天然饮食,并抽出肠外输注液中的营养成份仅补充摄入水分的不足。各类营养相互之间有一相互重叠的过程。在这过程中应该有细致的监测。
术后,除按腹部手术处理外,重点是免疫抑制剂的应用与抗感染。免疫抑制剂可以是环孢素A+硫唑嘌呤,有的还在这两种三联用药方案外,再加ATG成为四联方案。我们应用的是FK506+甲泼尼龙+骁悉。由于小肠移植尚处于临床开始应用阶段,免疫抑制剂的应用方案,有待进一步完善。小肠移植后,急性排斥率高达87.5%且多在术后1个月后发生。除此,尚有GVHD(供体对宿主的反应病)与慢性排斥发生,为了防止慢性排斥的发生,需要服用维持剂量的免疫抑制剂。常用的是CsA,全血药浓度维持在200μg/ml,或是应用FK506。全血药浓度维持10~15mg/L。
肠移植后有较高的肠道细菌易位的发生率,尤其在有排斥反应肠黏膜屏障发生损害时更易发生。如有发生,不但要应用抗菌药物,还得加大免疫抑制剂的剂量。除细菌感染外,由于应用大量免疫抑制剂药物,很易发生巨细胞病毒感染,如肺炎,肠炎等,巨细胞病毒肠炎可导致严重的腹泻。
13 并发症
小肠移植后的并发症除一般腹部手术后的并发症外,主要有排斥反应、感染和腹泻。
13.1 1.排斥反应(rejeerion)
(1)供体对宿主的反应症(GVHD guest versus host disease):GVHD是器官移植中供体对宿主的反应,较多出现在骨髓移植与肠移植。在鼠模型动物实验中,GVHD较常有出现。在临床病例中发生率较低。主要表现为全身症状、皮疹。皮疹病理切片可显示皮层与表皮层交界部有淋巴细胞浸润伴基层细胞退变。
(2)急性排斥(acute rejection):由于肠壁与系膜中有较多的淋巴组织,故小肠移植排斥的发生率较高。第7届国际小肠移植会议(2001年)报道全球注册的小肠移植共656例,排斥发生率为88%。Todo报道15例、16次肠移植中,排斥的发生率高达93.8%(15/16),术后第1个月的发生率为87.5%、(14/16),3个月时为28.6%(4/14),6个月时为36.4%,但在12个月时7例病人中仍有3例发生急性排斥,表现为发热、腹痛、呕吐与水样泻,重者可有肠麻痹、肠道出血、感染性休克与ARDS样表现。诊断主要是依据肠黏膜活检,病理切片观察。治疗是以大剂量肾上腺皮质激素冲击,增大免疫抑制CsA或FK506,与给予OKTs,抗淋巴细胞球蛋白,抗胸腺细胞球蛋白等。治疗适当,多数病人能够恢复。
(3)慢性排斥:慢性排斥的主要病变是小血管壁增厚,肠壁纤维化,症状为不可控制的腹泻、腹痛、间歇出现脓毒血症,进行性体重下降与间歇性肠道出血,肠镜检查示肠管黏膜有假膜形成,黏膜皱襞增厚,慢性溃疡到肠腔呈管状。如血管造影显示系膜血管弓有节段性狭窄,提示移植肠段应切除。
13.2 2.感染
小肠移植后除因免疫功能受抑制易有一般化脓性感染如肺炎与静脉导管有关的感染外,尚易有因肠道细菌易位引起的感染、霉菌感染与巨细胞病毒感染(cytomega lovirus infectien),细菌易位引起感染多与排斥有关,发生排斥时肠黏膜屏障功能受损,易有细菌易位。霉菌感染与细菌易位、应用免疫抑制剂与大剂量抗生素有关。巨细胞病毒在人群中有较高的携带率,器官移植后可因免疫抑制剂的应用而发生感染,常表现为肺炎或肠炎。因此,有学者主张在术后应用更昔洛韦(ganiclovir)或免疫球蛋白预防,诊断主要是依赖巨细胞病毒抗体试验。
13.3 3.腹泻
肠移植后腹泻的原因甚多,除排斥与巨细胞病毒感染外,还可以有菌群失调、霉菌感染。更可以由于神经被切断,淋巴管切断,激素失调,肠黏膜功能恢复不全等引起。因此,术后发生腹泻者甚多,可应用止泻剂,如复方苯乙哌啶、洛哌丁胺、白陶土、次碳酸铋等,有时还难以奏效,也有应用生长抑素者。有些病人切除了小肠与大部结肠而仅移植了小肠,小肠代偿功能缓慢,腹泻的时间可较长,在这些病人可同时移植回盲部与部分结肠(图1.6.5-11,1.6.5-12)。

