1 概述
肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)在早先时期与运动神经元疾病具有完全等同的含义,特指先有下运动神经元损害,之后又有上运动神经元损害的一个独立的疾病。但后来发现还有另外两种变异情况,即病程中始终只累及上运动神经元或下运动神经元,前者称为原发性侧索硬化,后者称为脊髓性肌萎缩。到目前为止有些文献仍沿用运动神经元病来专指肌萎缩侧索硬化。
多数学者习惯根据上、下运动神经元受累的不同组合,将运动神经元病分为肌萎缩侧索硬化、原发性侧索硬化和脊髓性肌萎缩三种类型。近年的研究提示肌萎缩侧索硬化与多种相关疾病有共同的病理基础,这些疾病包括原发性侧索硬化、ALS -痴呆、ALS-相关性额叶痴呆、进行性脊髓性肌萎缩、多系统萎缩和lewy小体病。病理检查发现这些疾病同样含有泛素阳性包涵体和透明团块包涵体,只是损伤了不同的解剖部位而出现各种各样的临床组合。
肌萎缩侧索硬化有家族性和散发性两种类型,散发性以男性多见,男女之比约为1.5∶1~2∶1。中年后起病,多数患者为50~70 岁,平均发病年龄为55 岁,40岁以下发病也有报告,20~30岁发病约占5%。家族性ALS占5%~10%,多为常染色体显性遗传,男女发病率相等,发病年龄较早,平均为49岁。
4 别名
MND;motor neuron disease;肌萎缩性侧索硬化;肌萎缩性脊髓侧索硬化;运动神经元病
7 流行病学
美国报告肌萎缩侧索硬化的发病率(每年新发病例)为2/10万~4/10万,患病率为4/10万~6/10万。国内尚无确切的流行病学资料。
肌萎缩侧索硬化有家族性和散发性两种类型,散发性以男性多见,男女之比约为1.5∶1~2∶1。中年后起病,多数患者为50~70岁,平均发病年龄为55岁,40岁以下发病也有报告,20~30岁发病约占5%。
9 发病机制
肌萎缩侧索硬化确切的发病机制至今尚未清楚。近年的研究主要集中在铜锌超氧歧化酶基因突变学说、兴奋性氨基酸毒性学说、自身免疫学说和神经营养因子学说。
9.1 铜锌超氧歧化酶基因突变学说
研究表明,20%的家族性ALS有SODI(Cu/Zn过氧化物歧化酶)基因突变。该基因位于人类染色体21q22.1,其突变可致SODl活性丧失,使超氧化的解毒作用减弱,致自由基过量积聚,细胞损伤。一些散发性的ALS可能也存在2lq22位点的突变。
9.2 兴奋性氨基酸毒性学说
兴奋性氨基酸包括谷氨酸、天冬氨酸及其衍生物红藻氨酸(KA)、使君子氨酸(QA)、鹅膏氨酸(IA)和N-甲基d-天冬氨酸(NMDA)。兴奋性氨基酸的兴奋毒性可能参与LIS的发病。谷氨酸与NMDA受体结合可致钙内流,激活一系列蛋白酶和蛋白激酶,使蛋白质的分解和自由基的生成增加,脂质过氧化过程加强,神经元自行溶解。此外过量钙还可激活核内切酶,使DNA裂解及核崩解。ALS的病变主要局限在运动神经系统可能与谷氨酸的摄取系统有关。这个摄取系统位于神经胶质细胞及神经细胞的细胞膜,能迅速将突触间隙的谷氨酸转运到细胞内,终止其作用。研究发现ALS的皮质运动细胞、脊髓胶质细胞和脊髓灰质细胞的谷氨酸摄取系统减少。动物实验研究也显示小鼠鞘内注射KA及NMDA可致脊髓神经元变性。
9.3 自身免疫学说
肌萎缩侧索硬化患者脑脊液和血清中抗神经元抗体的增加提示其发病可能与自身免疫有关。如存在于ALS患者血清中的L型电压依赖性钙通道抗体可与该通道蛋白结合,改变其电生理特性,造成神经元损伤。
10 病理改变
显微镜下观察可见脊髓前角细胞减少,伴胶质细胞增生,残存的前角细胞萎缩。大脑皮质的分层结构完整,锥体细胞减少伴胶质细胞增生。脊髓锥体束有脱髓鞘现象,而运动皮质神经元细胞完好,表明最初的改变产生于神经轴突的远端,逐渐向上逆行累及大脑中央前回的锥体细胞,此种改变又称为逆行性死亡。一些生前仅有下运动神经元体征的ALS患者,死后尸检可见显著的皮质脊髓束脱髓鞘改变,表明前角细胞功能受累严重,掩盖了上运动神经元损害的体征。还有一些临床表现典型的ALS,其病理改变类似于多系统变性,即有广泛的脊髓结构损害,脊髓前角、锥体束、脊髓小脑后束、脊髓后索的神经根间区、Clarke核以及下丘脑、小脑齿状核和红核均有神经元细胞脱失和胶质细胞增生(Terao,1991)。
采用免疫组织化学染色方法可以在中枢神经系统的不同部位的神经细胞发现异常的泛素阳性包涵体(Arima,1998,Kinoshita etal,1997,张巍,2001)。
这些包涵体包括以下几种类型:
(1)线团样包涵体,电镜下包涵体为条索或管状,通常带有中央亮区为嗜酸或两染性。被一淡染晕区包绕,在HE染色中不易见到。
(2)透明包涵体,为一种颗粒细丝包涵体。细丝直径为15~20nm,颗粒物质混于细丝间形成小绒球样致密结构,外周常有溶酶体样小体及脂褐素等膜性结构包绕。
(3)路易体样包涵体,为一圆形包涵体,由不规则线样结构与核糖体样颗粒组成,中心为无定形物质或颗粒样电子致密物,这些物质包埋于18nm细丝中,排列紧密或松散,外周有浓染的环,类似路易体。
(4)Bunina小体,是ALS较具有特异性的病理改变。这些包涵体主要分布于脊髓的前角细胞和脑干运动核神经细胞,也可以出现在部分运动神经元病患者的海马颗粒细胞和锥体细胞、齿状回、嗅皮质、杏仁核、Onuf核、额颞叶表层小神经元和大锥体细胞胞质中(Arima,1998,Kinoshitaetal,1997)。
11 肌萎缩侧索硬化的临床表现
1.肌萎缩侧索硬化起病隐匿,缓慢进展。
2.半数患者首发症状为肢体无力伴肌萎缩(5%)和肌束颤动(4%),上肢远端尤其突出。此时四肢腱反射减低,无锥体束征,临床表现类似于脊髓性肌萎缩。
3.随着病情的发展患者逐渐出现典型的上下运动神经元损害的体征,表现为广泛而严重的肌肉萎缩,肌张力增高,锥体束征阳性。60%的患者具有明显的上下运动神经元体征。当下运动神经元变性达到一定程度时,肌肉广泛失神经,此时可无肌束颤动,腱反射减低或消失,也无病理征。
4.约有10%的患者在整个病程中仅表现为进行性的肌肉萎缩而无上运动神经元损害的体征。
5.约30%的患者以脑干的运动神经核受累起病,表现为吞咽困难、构音不清、呼吸困难、舌肌萎缩和纤颤,以后逐渐累及四肢和躯干。情绪不稳定(强哭强笑)是上运动神经元受累及假性延髓性麻痹的征象。
6.以脊髓侧索受累为首发症状的肌萎缩侧索硬化罕见。9%的患者可有痛性痉挛,后者是上运动神经元损害的表现,多在受累的下肢近端出现,常见于疾病的早期。10%的患者有主观的肢体远端感觉异常或麻木,除非合并其他周围神经病,ALS无客观的感觉体征。整个病程中膀胱和直肠功能保持良好,眼球运动通常不受损害。
7.单纯的肌萎缩侧索硬化患者一般没有智力减退。肌萎缩侧索硬化伴有其他神经系统变性疾病的症状和体征时,称ALS叠加综合征(ALS-plus syndrome)。该综合征主要发生在西太平洋地区、日本的关岛和北非等地区。合并的症状和体征包括锥体外系症状、小脑变性、痴呆、自主神经和感觉系统症状以及眼球运动异常。
8.神经肌肉电生理改变 主要表现为广泛的神经源性损害。急性神经源性损害(失神经后2~3周)的特征为纤颤电位、正锐波、束颤电位和巨大电位,慢性失神经伴有再生时表现为肌肉轻收缩时运动单位动作电位时限增宽、波幅明显升高及多相波百分比上升,肌肉大力收缩时可见运动单位脱失现象。ALS的神经源性损害通常累及3个以上的区域(脑神经、颈、胸、腰骶神经支配区)。舌肌、胸锁乳突肌和膈肌也可表现为神经源性损害,后者因为在颈椎病中较少受累,因而可资对两者进行鉴别(康德暄,1994)。MCV可有轻度减慢,诱发电位波幅下降。感觉传导速度多正常。
磁刺激运动诱发电位:经颅刺激大脑皮质运动神经元,并在相应的肌肉记录到动作电位,该方法可测定中枢运动传导时间,对确定皮质脊髓束的损害具有重要价值。
14 辅助检查
14.1 神经肌肉电生理检查
表现为广泛的神经源性损害。
急性神经源性损害(失神经后2~3周)的特征为纤颤电位、正锐波、束颤电位和巨大电位,慢性失神经伴有再生时,表现为肌肉轻收缩时运动单位动作电位时限增宽、波幅明显升高及多相波百分比上升,肌肉大力收缩时可见运动单位脱失现象。
14.2 磁刺激运动诱发电位
磁刺激运动诱发电位可测定中枢运动传导时间,对确定皮质脊髓束的损害具有重要价值。
14.3 肌肉活检
15 肌萎缩侧索硬化的诊断
1994年世界神经病学联盟为了进行大规模的肌萎缩侧索硬化临床治疗研究,提出了一个肌萎缩侧索硬化的筛选诊断标准,该标准对临床实践并不实用。
1998年Rowland在此基础上进行修改,提出以下诊断标准:
15.1 肌萎缩侧索硬化必须具备的条件
(1)20岁以后起病。
(2)进展性,无明显的缓解期和平台期。
15.2 支持脊髓性肌萎缩(SMA)的条件
(1)上述的下运动神经元体征。
(2)腱反射消失。
(3)无Hoffmann和Babinski征。
15.3 支持肌萎缩侧索硬化的条件
(2)必须有Hoffmann或Babinski征阳性或有膝、踝震挛。
(3)可有假性延髓性麻痹和情感不稳定或强哭强笑(emotional lability)。
(4)多为消瘦体型。
15.4 有可疑上运动神经元体征(possible upper motor neurone signs)的ALS(即ALS-PUMNS)
(1)上述下运动神经元受累体征。
(3)无Hoffmann或Babinski征或膝、踝震挛。
15.5 原发性侧索硬化的诊断标准
(1)必要条件:①成人起病;②无中风史或支持多发性硬化的缓解复发病史;③家族中无类似病史;④痉挛性截瘫;⑤下肢腱反射亢进;⑥Babinski征阳性或有踝震挛;⑦无局限性肌无力、肌萎缩及肢体或舌肌束颤;⑧无持续性的感觉异常或肯定的感觉缺失;⑨无痴呆;⑩肌电图无失神经的证据。
(2)符合和支持诊断的条件:①假性延髓性麻痹(吞咽困难、构音障碍);②上肢的上运动神经元体征(手活动不灵活、轮替动作缓慢笨拙、双臂腱反射、活跃、Hoffmann征阳性);③痉挛性膀胱症状;④MRI示运动皮质萎缩及皮质脊髓束高信号;⑤磁共振光谱(magnetic resonance spectroscope)有皮质乙酰天门冬氨酸缺失的证据;⑥运动皮质磁刺激示中枢运动传导损害。
(3)诊断原发性侧索硬化还应注意排除下列疾病:①MRI排除多发性硬化,后脑畸形、枕骨大孔区压迫性损害、颈椎病性脊髓病、脊髓空洞和多发性脑梗死; ②血液检查排除维生素Bl2缺乏、HTLV-1(human T lymphocyte leukemia virus)、极长链脂肪酸(排除肾上腺脑白质营养不良)、Lyme抗体、梅毒血清实验、免疫电泳(排除副蛋白血症);③脑脊液检查排除多发性硬化、HTLV-1感染和神经梅毒。
16 鉴别诊断
肌萎缩侧索硬化的鉴别诊断比较复杂,根据Belsh和Schiffman的统计,本病早期有27%被误诊为其他疾病,在爱尔兰的国家ALS登记处有10%的病例为误诊。
中晚期的肌萎缩侧索硬化诊断并不困难,但在疾病早期需与以下疾病进行鉴别。
16.1 颈椎病脊髓
脊髓型颈椎病可以表现为手肌无力和萎缩伴双下肢痉挛,而且颈椎病和ALS均好发于中年以上的人群,两者容易混淆。由于颈椎病引起的压迫性脊髓损害很少超过C4,因而舌肌和胸锁乳突肌肌电图检查发现失神经现象强烈提示ALS。超过一个神经根分布区的广泛性肌束颤动也支持ALS的诊断。颈椎病性脊髓病时MRI可显示脊髓受压,但出现这种影像学改变并不能排除ALS。一方面有些患者虽然影像学有颈髓受压的证据,但并不一定导致出现脊髓损害的症状和体征,另一方面,颈椎病可与ALS同时存在。
16.2 包涵体肌炎(IBM)
包涵体肌炎是继颈椎病性脊髓病后最容易与ALS混淆的疾病,Brannagan(1999)复习20例IBM,其中半数早期误诊为ALS或周围神经病。两者的共同症状为手肌或四肢远端肌萎缩,腱反射消失,无感觉障碍和感觉异常(IBM合并周围神经病除外)。
IBM患者指屈肌无力通常较为明显,而在ALS到晚期其他手肌明显受累时才有指屈肌无力,且第1骨间肌多无萎缩。IBM常有明显的股四头肌萎缩伴上楼费力和起立困难,但无束颤和上运动神经元损害体征。IBM患者的肌肉活检可见镶边空泡和炎症浸润可资与ALS鉴别。
16.3 多灶性运动神经病
多灶性运动神经病是一种周围神经病。因其有明显的肌无力和肌萎缩伴肌束颤动,而腱反射正常或亢进,容易与ALS或SMA混淆。神经电生理检查发现运动传导阻滞、运动神经活检发现脱髓鞘改变及IVIG试验性治疗有效支持多灶性运动神经病。磁共振光谱有皮质乙酰天门冬氨酸缺失及运动皮质磁刺激发现中枢运动传导障碍提示ALS。
16.4 Kennedy-Alter-Song综合征
与ALS的共同点是两者均有下运动神经元受损的症状和体征。Kennedy-Alter-Song综合征还有以下特点可资与ALS鉴别:①X连锁遗传方式;②姿位性震颤伴乳房肿大;③无上运动神经元的症状和体征;④近端肌无力为主,面部肌肉和吞咽肌容易受累、撅嘴动作可诱发下巴颤搐(twitching);⑤有时伴有皮肤感觉异常和感觉缺失;⑥腓肠神经感觉电位活动丧失;⑦基因分析有三核苷酸(CAG)重复增多。
16.5 氨基己糖苷酶缺乏症
氨基己糖苷酶缺乏症又称GM2神经节苷脂累积病或Tay-Sach disease。因有上下运动神经元损害的体征易与ALS混淆。不同之处为前者多为儿童或青少年起病,进展缓慢,有小脑体征,有些患者可伴抑郁性精神病和痴呆。
16.6 良性肌束颤动
良性肌束颤动病因未明。其特点为广泛束颤不伴肌无力、肌萎缩和腱反射异常。正常人在疲劳、寒冷、焦虑、剧烈运动及抽烟和喝咖啡时容易出现。EMG有自发性电活动,但无运动单位的形状改变。在少数情况下束颤可为ALS的首发症状,应引起注意。肌束颤动高度提示运动神经元核周病变,除多灶性运动神经病和淀粉周围神经病外,其他周围神经病罕见。肌病患者出现束颤时应警惕合并周围神经病的可能。
16.7 平山病
平山病又称单肢脊髓性肌萎缩(monomelic spinal muscular atrophy)或青年上肢远端肌萎缩。特点为20岁左右起病,临床表现为肌萎缩、肌无力、肌束颤动和痉挛。症状进展1年左右停止,MRI可正常或见脊髓萎缩。一些患者早期表现为平山病,以后发展为ALS。
16.8 重症肌无力
咽喉部位受累者须与以延髓麻痹为首发症状的ALS鉴别,前者有典型的肌无力和病态疲劳,休息后好转。新斯的明试验阳性,肌电图正常,重频刺激试验阳性。有些ALS患者应用新斯的明后肌无力症状也有一定程度的改善,应注意与重症肌无力鉴别。
16.9 脊髓灰质炎后综合征(postpolio syndrome)
脊髓灰质炎后综合征是指瘫痪型脊髓灰质炎患者在患病20~25年后出现缓慢进展的肌无力和肌萎缩,多见于肌萎缩后遗症最严重的部位,偶尔累及其他未受累肌群。进展缓慢、无上运动神经元的体征以及几乎不累及生命可资与ALS鉴别。
16.10 甲状腺功能亢进合并肌萎缩侧索硬化症状群
国外已有近20个病例报告。甲状腺功能亢进患者可合并单纯下运动神经元、单纯上运动神经元体征和上下运动神经元损害的体征,其中84%的患者抗甲状腺治疗后ALS症状群获得改善。甲亢患者出现这些可逆性ALS症状群的确切机制尚不清楚,但可以肯定是神经系统受累,而非甲状腺肌病。
16.11 副肿瘤性肌萎缩侧索硬化
尽管有许多研究显示ALS患者的肿瘤发病率与正常人相比并不增加,但一些合并肿瘤的ALS患者在肿瘤切除之后,ALS的症状和体征可以完全消失。表明二者在病理发生机制方面有一定联系。淋巴瘤与ALS的关系似乎更为密切,尽管淋巴瘤合并单纯下运动神经元损害时可能与运动性周围神经病有关,但国外学者报告61例ALS合并淋巴瘤,其中半数以上合并上运动神经元体征,而在尸检病例中,又有半数以上可见皮质脊髓束受累。少数(不到10%)患者免疫抑制治疗后ALS的症状可缓解。
16.12 中枢神经的多系统变性
临床上典型的ALS症状群可合并痴呆、帕金森症状群及小脑体征等,被称为ALS叠加综合征,此时应与多系统萎缩、CJD、Alzheimer病、Huntington舞蹈病和Machado-Joseph病等鉴别。
16.13 其他脊髓病
亚急性联合变性、人类T淋巴细胞白血病病毒相关性脊髓病(HAM)、Lyme病、梅毒和多发性硬化有时也可引起类ALS症状群。
16.14 中毒性周围神经病
17 肌萎缩侧索硬化的治疗
长期以来肌萎缩侧索硬化缺乏有效的治疗措施。1995年力鲁唑(力如太)作为ALS的标准治疗药物上市后,经过大量的临床验证发现该药可延长肌萎缩侧索硬化患者处于疾病轻、中度状态和存活的时间,推迟肌萎缩侧索硬化发生呼吸困难的时间,但不能使已经出现的运动障碍获得改善。该药主要是通过抑制突触前谷氨酸的释放,阻滞兴奋性氨基酸受体,抑制神经末梢和神经细胞体上的电压依赖性钠通道而发挥作用。用药方法为50mg,2次/d,口服,疗程为1~1.5年。该药耐受性好,常见副反应有恶心、乏力和谷丙转氨酶升高。
肌萎缩侧索硬化的对症治疗对改善患者的生存质量具有重要意义。物理治疗可延缓肌萎缩的进展,预防关节挛缩。吞咽功能障碍时应及时插胃管或行胃造瘘手术,保证营养供应,避免呛咳导致的吸入性肺炎。发生呼吸困难时应行气管切开,机械通气。对劳累性呼吸困难的患者可给间歇性正压辅助呼吸,此种辅助呼吸器材体积小,操作方便,可随身携带,患者容易接受。对有痛性痉挛或严重痉挛状态的患者可给卡马西平0.1,3次/d或巴氯芬,初始剂量为5mg,3次/d,以后每3天增加5mg,有效剂量范围为30~75mg,最大剂量可达100~120mg。
22 诊疗指南
22.1 概述
肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)是一种病因未明、主要累及大脑皮质、脑干和脊髓运动神经元的神经系统变性疾病。其局限性分型包括进行性球麻痹(PBP),连枷臂、腿,进行性肌萎缩(PMA),原发性侧索硬化(PLS)。ALS 以进行性发展的骨骼肌萎缩、无力、肌束颤动、延髓麻痹和锥体束征为主要临床表现。一般中老年发病,生存期通常 3~5 年。
22.2 病因和流行病学
大约 90%的 ALS 发病机制目前尚不明确。国内外学者普遍认为,ALS的发病是基因与环境共同作用的结果。较为常见的 ALS 致病基因包括SOD1,TDP-43,研究显示,由 FUS、SOD1 及 OPTN3 种基因的突变造成的患者不超过2%,而25.6%~30.6%的家族性 ALS 患者有 SOD1 突变。其他可能的发病机制包括RNA加工异常、谷氨酸兴奋性毒性、细胞骨架排列紊乱、线粒体功能障碍、病毒感染、细胞凋亡、生长因子异常、炎症反应等。
欧洲及美国年发病率是 2/10 万~3/10 万,患病率为(3~5)/10 万。发病的高峰年龄为 50~75 岁,不随着年龄增加而增高。约 10%ALS 患者为家族性,余90%为散发性。ALS 中男女患病率比例为(1.2~1.5):1。家族性ALS 的平均发病年龄较散发性 ALS 发病年龄早。中国 ALS 的流行病学数据主要来自中国(中国香港地区),发病率约 0.6/10 万人,患病率约 3.1/10 万人。
22.3 临床表现
ALS 是一种上、下运动神经元同时受累的神经系统变性疾病。临床主要表现为球部、四肢、胸腹部肌肉进行性无力和萎缩。而眼球运动神经和括约肌功能一般并不受累,但在有些患者晚期也可能会被累及。20%~50%的患者可以表现有认知功能障碍,5%~15%的患者甚至会发展为额颞叶痴呆。发病后平均3~5年因呼吸衰竭死亡,但 5%~10%的患者可以存活 10 年以上。
22.4 辅助检查
通过详细的病史和体格检查,在脑干、颈、胸、腰骶4 个区域中寻找上、下运动神经元共同受累的证据,是诊断 ALS 的基础。查体发现在同一区域,同时存在上、下运动神经元受累的体征是诊断 ALS 的要点。其中下运动神经元受累体征主要包括肌肉无力、萎缩和肌束颤动。通常检查舌肌、面肌、咽喉肌、颈肌、四肢不同肌群、背肌和胸腹肌。上运动神经元受累体征主要包括病理征阳性、腱反射亢进、肌张力增高、阵挛等。通常检查吸吮反射、咽反射、下颌反射、掌颌反射,有无强哭、强笑等假性延髓麻痹表现,四肢腱反射、肌张力、霍夫曼征、下肢病理征、腹壁反射等。临床查体是发现上运动神经元受累的主要方法,在出现萎缩、无力的区域,如果腱反射不低或活跃,即使没有病理征,也可以提示锥体束受损。
22.4.1 1.神经电生理检查
当临床考虑为 ALS 时,需要进行神经电生理检查,以确认临床受累区域为下运动神经元病变,并发现在临床未受累区域也存在的下运动神经元病变,同时协助排除其他疾病。神经电生理检查可以看作是临床查体的延伸,应该由合格的肌电图医生或技师完成,并依据明确的标准进行判断。
(1)神经传导测定:神经传导测定主要用来诊断或排除周围神经疾病。运动和感觉神经传导测定应至少包括上、下肢各 2 条神经。
1)运动神经传导测定:远端运动潜伏期和神经传导速度通常正常,无运动神经部分传导阻滞或异常波形离散。随病情发展,复合肌肉动作电位波幅可以明显下降,传导速度也可以有轻微减慢。
2)感觉神经传导测定:一般正常。当存在嵌压性周围神经病或同时存在其他的周围神经病时,感觉神经传导可以异常。在进行下肢的感觉神经传导测定时,有些老年患者很难引出感觉神经动作电位,并不一定是异常。
3)F 波测定:通常正常。当肌肉明显萎缩时,相应神经可见F 波出现率下降,而传导速度相对正常。
(2)同芯针肌电图检查:下运动神经元病变的判断主要通过同芯针肌电图检查。肌电图可以证实进行性失神经和慢性失神经的表现。
1)进行性失神经表现:主要包括纤颤电位、正锐波和束颤电位。当同时存在慢性失神经的表现时,束颤电位与纤颤电位、正锐波具有同等临床意义。
2)慢性失神经的表现:运动单位电位的时限增宽、波幅增高,通常伴有多相波增多;大力收缩时运动单位募集相减少,发放频率升高,当同时存在上运动神经元受累的体征时,发放频率的测定会受到影响;大部分ALS 可见发放不稳定、波形复杂的运动单位电位。
3)诊断 ALS 时,肌电图必须存在慢性失神经的表现,但并不一定都有纤颤电位或正锐波。当肌电图检查提示进行性失神经和慢性失神经共存时,对于诊断ALS 有更强的支持价值。如果所有测定区域均无进行性失神经表现,诊断ALS需慎重。
4)肌电图诊断 ALS 时的检测范围:应对 4 个区域均进行肌电图测定。其中脑干区域可以测定一块肌肉,如胸锁乳突肌、舌肌、面肌或咬肌。胸段可在胸6水平以下的脊旁肌或腹直肌进行测定。对于颈段和腰骶段,应至少测定不同神经根和不同周围神经支配的两块肌肉。
5)在 ALS 早期,肌电图检查时可以仅仅出现 1 个或2 个区域的下运动神经元损害。此时对于临床怀疑 ALS 的患者,需要间隔 3 个月进行随访复查。6)肌电图出现 3 个或以上区域的下运动神经源性损害时,并非都是ALS。电生理检查结果应该密切结合临床进行分析,不应孤立的对肌电图结果进行解释。
(3)运动诱发电位:经颅磁刺激运动诱发电位检测有助于发现临床下的锥体束损伤,主要表现为中枢运动传导时间延长。
22.4.2 2.神经影像学检查
(1)脑或脊髓的影像学检查有助于 ALS 与其他疾病鉴别,排除结构性损害。例如颅底、脑干、脊髓或椎管结构性病变导致上和(或)下运动神经元受累时,相应部位的 MRI 检查可提供帮助。
(2)某些常见疾病,如颈神经根脊髓病等,常与ALS 合并存在,需要注意鉴别。
22.4.3 3.基因检测
自 20 世纪 90 年代以来,已发现 SOD1、ANG、VAPB、VCP、SQSTM1、TARDBP、DCTN1、DAO、SETX、FUS、C9ORF72、ATXN2、OPTN、SCFD1、NEK1、C21ORF2 等 20 多个基因突变。建议充分、详细询问ALS患者及其兄弟姐妹的病史以及患者父母、祖父母的详细病史和其兄弟姐妹的病史。
22.5 诊断
ALS 的早期临床表现多样,缺乏特异的生物学确诊指标。详细的病史、细致的查体和规范的肌电图检查对于早期诊断具有关键性的作用。影像学等其他辅助检查在鉴别诊断中具有一定价值。根据患者所出现症状、体征的解剖部位,可分为脑干、颈、胸和腰骶 4 个区域;根据临床和肌电图检查所证实的上、下运动神经元受累区域多少,可分为不同的 ALS 诊断级别(EI Escorial 标准修订版)(表4-1)。
1.临床确诊 ALS 通过临床或电生理检查,证实在4 个区域中至少有3 个区域同时存在上、下运动神经元同时受累的证据。
2 临床拟诊 ALS 通过临床或电生理检查,证实在4 个区域中至少有2 个区域同时存在上、下运动神经元同时受累的证据。
3.实验室支持的拟诊 ALS1 个区域上、下运动神经元同时受累或仅有上运动神经元受累伴电生理检查提示至少 2 个区域的下运动神经元受累,影像和实验室检查排除其他疾病。
4.临床可能 ALS:通过临床或电生理检查,证实仅有1 个区域存在上、下运动神经元同时受累的证据,或者在 2 个或以上区域仅有上运动神经元受累的证据。已经行影像学和实验室检查排除了其他疾病。
表 4-1ALS 诊断标准
核心标准:
1.下运动神经元体征(包括肌电图有表现但在临床上未累及的肌肉)2.上运动神经元体征
3.症状和体征逐渐进展
排除标准:
2.括约肌障碍
3.视觉障碍
6.阿尔茨海默型痴呆
7.类 ALS 综合征(如解剖变异/压迫综合征,获得性酶缺陷,自身免疫性综合征,中毒,感染,内分泌异常等)支持标准:
1.在一个或多个区域肌束震颤
3.运动和感觉神经正常
4.无传导阻滞
22.6 鉴别诊断
在 ALS 的诊断过程中,根据症状和体征的不同,需要与多种疾病进行鉴别,常见的有颈椎病、腰椎病、多灶性运动神经病、平山病、成人脊髓性肌萎缩、肯尼迪病、遗传性痉挛性截瘫等。
22.7 治疗
尽管 ALS 仍是一种无法治愈的疾病,但有许多方法可以改善患者的生活质量。早期诊断,早期治疗,尽可能地延长生存期。治疗上除了延缓病情发展和对症治疗的药物外,还包括营养管理、呼吸支持和综合治疗等。
22.7.1 1.药物治疗
(1)利鲁唑:化学名为 2-氨基-6(三氟甲氧基)-苯并噻唑。其作用机制包括稳定电压门控钠通道的非激活状态、抑制突触前谷氨酸释放、激活突触后谷氨酸受体以促进谷氨酸的摄取等。该药是目前唯一证实可以在一定程度上延缓病情发展的药物,用法为 50mg,每日 2 次口服。常见不良反应为疲乏和恶心,个别患者可出现肝转氨酶升高,需注意监测。当患者已经使用有创呼吸机辅助呼吸时,不建议继续服用。
(2)其他药物:依达拉奉在部分国家被批准可以用于早期ALS 患者的治疗,众多针对不同发病机制的临床试验也仍在进行。临床上也常使用多种维生素治疗。另外,根据患者情况,可以选用不同的对症治疗药物以改善抑郁、焦虑、失眠、流涎、肢体痉挛、疼痛等症状。
22.7.2 2.营养管理
(1)能够正常进食时应采用均衡饮食;吞咽困难时宜采用高蛋白、高热量饮食以保证营养摄入。进食软食、半流食,少食多餐。(2)当患者吞咽明显困难、体重下降、脱水或存在呛咳误吸风险时,应尽快行经皮内镜胃造瘘术(percutaneous endoscopic gastrostomy,PEG)。对于拒绝或无法行 PEG 者,可采用鼻胃管进食。
3.呼吸支持当 ALS 患者出现呼吸肌无力时,需要尽早考虑治疗的方法,与患者和家属就无创通气、有创通气以及后期的处理达成共识。在使用有创呼吸机辅助呼吸前,建议定期检查肺功能。
4.综合治疗 ALS 患者治疗过程中,应注重多科协作,涉及神经科、呼吸内科、消化内科、心理科、康复科、营养科等,护理人员在其中也发挥着重要作用。
22.8 诊疗流程
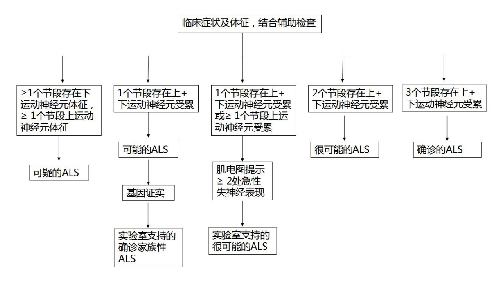
图 4-1 肌萎缩侧索硬化(ALS)诊疗流程
根据 EI Escorial 标准修订版
22.9 参考文献
[1] Brown RH, Al-Chalabi A.Amyotrophic Lateral Sclerosis. NEngl JMed,2017,377(2):162-172.
[2] Brooks BR, Miller RG, Swash M, et al. For the World Federation of NeurologyResearch Committee on Motor Neuron Disease. EI Escorial revisited: revisedcriteria for the diagnosis of amyotrophic lateral sclerosis. Amyotrophic Lateral Sclerosis, 2000,1:293-300.
[3] Ludolph A, Drory V, Hardiman O, et al. Arevisionof theElEscorialcriteria-2015. Amyotroph Lateral Scler Frontotemporal Degener, 2015,16(5-6):291-292.