1 拼音
gǔ suǐ zēng shēng yì cháng zōng hé zhēng bàn yuán shǐ xì bāo zēng duō ( M D S - E B ) zhěn liáo zhǐ nán ( 2 0 2 2 nián bǎn )
2 基本信息
《骨髓增生异常综合征伴原始细胞增多(MDS-EB)诊疗指南(2022年版)》由国家卫生健康委办公厅于2022年4月3日《国家卫生健康委办公厅关于印发肿瘤和血液病相关病种诊疗指南(2022年版)的通知》(国卫办医函〔2022〕104号)印发,要求各省、自治区、直辖市及新疆生产建设兵团卫生健康委组织做好实施工作。
3 发布通知
国家卫生健康委办公厅关于印发肿瘤和血液病相关病种诊疗指南(2022年版)的通知
国卫办医函〔2022〕104号
各省、自治区、直辖市及新疆生产建设兵团卫生健康委:
为进一步提高肿瘤和血液病诊疗规范化水平,保障医疗质量安全,维护患者健康权益,我委委托有关单位制修订了肿瘤和血液病相关病种诊疗指南。现印发给你们(见附件,可在国家卫生健康委网站医政医管栏目下载),请各地卫生健康行政部门组织做好实施工作。
附件:
2.膀胱癌诊疗指南(2022年版)
5.胰腺癌诊治指南(2022年版)
6.肾癌诊疗指南(2022年版)
7.乳腺癌诊疗指南(2022年版)
8.子宫内膜癌诊疗指南(2022年版)
12.甲状腺癌诊疗指南(2022版)
13.脑胶质瘤诊疗指南(2022年版)
16.弥漫性大B细胞淋巴瘤诊疗指南(2022年版)
17.骨髓增生异常综合征伴原始细胞增多(MDS-EB)诊疗指南(2022年版)
18.慢性髓性白血病诊疗指南(2022年版)
19.血友病A诊疗指南(2022年版)
20.慢性淋巴细胞白血病-小淋巴细胞淋巴瘤诊疗指南(2022年版)
国家卫生健康委办公厅
2022年4月3日
4 诊疗指南全文
骨髓增生异常综合征伴原始细胞增多(MDS-EB)诊疗指南(2022年版)
4.1 一、概述
骨髓增生异常综合征(myelodysplastic syndromes,MDS)是一组起源于造血干细胞的异质性髓系克隆性疾病,其特点是髓系细胞发育异常,表现为无效造血、难治性血细胞减少,高风险向急性髓系白血病(acute myelogenousleukemia,AML)转化。
MDS 的诊断与分型标准自1982 年由FAB 协作组首次确立以来,在过去近 40 年里几经补充修改,日趋完善。其中MDS伴原始细胞增多(myelodysplastic syndromes withexcessblasts,MDS-EB)亚型是指骨髓中原始细胞达5%~19%,较其他亚型向 AML 转化的风险进一步提高。
4.2 二、诊断技术和应用
4.2.1 (一)发病情况。
MDS 全球发病率约为(2~12)/10 万,中国发病率为(0.23~1.51)/10 万。MDS 发病率随年龄增长而增加,80%发病年龄大于 60 岁。男性多于女性,德国资料≥70岁人群中 MDS 发病率,男性 33.9/10 万,女性18/10 万;瑞典资料中 MDS 男性与女性之比为 1.8∶1。
4.2.2 (二)临床表现。
MDS-EB 的临床表现无特异性,以全血细胞减少为主,常有明显贫血、出血及感染表现,可伴有脾肿大,常在短期内进展为急性白血病,转化率高达40%,部分患者虽未进展为急性白血病,但常因感染及出血而死亡。
4.2.3 (三)实验室检查。
MDS 诊断依赖于多种实验室检测技术的综合使用,其中骨髓穿刺涂片细胞形态学和细胞遗传学检测技术是MDS诊断的核心。
4.2.3.1 1.必需的检测项目。
4.2.3.1.1 (1)骨髓穿刺涂片:
MDS 患者外周血和骨髓涂片的形态学异常分为 2 类:原始细胞比例增高和细胞发育异常。原始细胞可分为 2 型:1 型(EB-1)为无嗜天青颗粒的原始细胞;2 型(EB-1)为有嗜天青颗粒但未出现核旁空晕区的原始细胞,出现核旁空晕区者则判断为早幼粒细胞。典型的MDS患者,发育异常细胞占相应系别细胞的比例≥10%。拟诊MDS患者均应进行骨髓铁染色计数环状铁粒幼红细胞,其定义为幼红细胞胞质内蓝色颗粒在 5 颗以上且围绕核周1/3以上者。
4.2.3.1.2 (2)骨髓活检病理:
所有怀疑为MDS 的患者均应行骨髓活检,通常在髂后上棘进行,长度不少于1.5 cm。骨髓活检细胞学分析有助于排除其他可能导致血细胞减少的因素或疾病,并提供骨髓细胞增生程度、巨核细胞数量、原始细胞群体、骨髓纤维化程度及肿瘤骨髓转移等重要信息。怀疑为 MDS 的患者应行 Gomori 银染色和原位免疫组化,常用的检测标志包括 CD34、MPO、GPA、CD61、CD42、CD68、CD20和 CD3。
4.2.3.1.3 (3)染色体核型分析:
所有怀疑MDS 的患者均应进行染色体核型检测,通常需分析≥20 个骨髓细胞的中期分裂象,并按照《人类细胞遗传学国际命名体制(ISCN)2013》进行核型描述。40%~60%的 MDS 患者具有非随机的染色体异常,其中以+8、-7/del(7q)、del(20q)、-5/del(5q)和-Y最为多见。MDS 患者常见的染色体异常中,部分具有诊断价值:①不平衡染色体异常:-7/del(7q);del(5q);(i17q)/t(17p);-13/del(13q);del(11q);del(12p)/t(12p);del(9q);idic(X)(q13)。②平衡染色体异常:(t11;16)(q23.3;p13.3);(t3;21)(q26.2;q22.1);(t1;3)(p36.3;q21.2);(t2;11)(p21;q23.3);inv(3)(q21.3;q26.2)/t(3;3)(q21.3;q26.2);(t6;9)(p23;q34.1)。而+8、del(20q)和-Y 亦可见于再生障碍性贫血及其他血细胞减少疾病。形态学未达到标准(1系或多系细胞发育异常比例<10%)、但同时伴有持续性血细胞减少的患者,如检出具有 MDS 诊断价值的细胞遗传学异常,应诊断为 MDS 未分类型(MDS-U)。
4.2.3.2 2.推荐的检测项目。
4.2.3.2.1 (1)荧光原位杂交技术:
应用针对MDS 常见异常的组套 探 针 进 行 荧 光 原 位 杂 交(fluorescence insituhybridization,FISH)检测,可提高部分MDS 患者细胞遗传学异常检出率。因此,对疑似MDS 者,骨髓干抽、无中期分裂象、分裂象质量差或可分析中期分裂象<20 个时,应进行 FISH 检测,通常探针应包括:5q31、CEP7、7q31、CEP8、20q、CEPY 和 TP53。
4.2.3.2.2 (2)骨髓流式细胞术检查:
目前尚无MDS 特异性的抗原标志或标志组合。对于缺乏确定诊断意义的细胞形态学或细胞遗传学表现的患者,不能单独依据流式细胞术检测结果确定 MDS 诊断。但流式细胞术对于MDS 的预后分层有应用价值。
4.2.3.2.3 (3)基因突变检测:
新一代基因测序技术可以在绝大多数 MDS 患者中检出至少 1 个基因突变。MDS 常见基因突变包括 TET2、RUNX1、ASXL1、DNMT3A、EZH2、SF3B1 等。部分基因的突变状态对 MDS 的鉴别诊断和危险度分层中有一定的价值,推荐作为选做检测项目,包括:TP53、TET2、DNMT3A、IDH1/2、EZH2、ASXL1、SRSF2、RUNX1、U2AF1、SETBP1等。
4.2.4 (四)诊断标准。
原始细胞增多是 MDS-EB 主要的诊断标准:
1.MDS-EB-1:骨髓 5%~9%或外周血2%~4%,无Auer小体。
2.MDS-EB-2:骨髓 10%~19%或外周血5%~19%或有Auer小体。
4.2.5 (五)预后分层。
MDS 患者常用危险度分层系统包括国际预后评分系统(international prognostic score system,IPSS)、WHO分型预后积分系统 (WHO adapted prognostic scoringsystem,WPSS)和修订的国际预后积分系统(revisedinternational prognostic scoring system,IPSS-R)。此外,安德森癌症中心(MD Anderson Cancer Center,MDACC分层系统除了常用主要参数外,还引入了年龄、体能状态等参数。
1.IPSS:IPSS 危险度的分级1997 制定,根据以下3个因素确定:骨髓原始细胞比例、血细胞减少的程度和骨髓细胞遗传学特征。骨髓原始细胞5%~10%(EB-1)积分0.5分,骨髓原始细胞 11%~20%(EB-2)积分1.5 分。
2.WPSS:2007 年制定,红细胞输注依赖及铁过载不仅导致器官损害,也可直接损害造血系统功能,从而可能影响MDS 患者的自然病程。2011 年修订的WPSS 预后评分系统将评分依据中的红细胞输注依赖改为血红蛋白水平。WPSS作为一个时间连续性的评价系统,可在患者病程中的任何时点对预后进行评估。骨髓原始细胞5%~10%(EB-1)积分2分,骨髓原始细胞 11%~20%(EB-2)积分3 分。
3.IPSS-R:IPSS-R 积分系统被认为是MDS 预后评估的金标准,是 MDS 预后国际工作组在2012 年对IPSS预后评分系统修订的最新版本,其对预后的评估效力明显优于IPSS、WPSS。2%<骨髓原始细胞<5%积分1 分,骨髓原始细胞 5%~10%(EB1)积分 2 分,骨髓原始细胞>10%(EB-2)积分 3 分。然而,IPSS-R 也有其局限性。其预后评估是否适用于接受化疗或靶向药物治疗的患者依然未知;再者,其他具有独立预后意义的因素未包含其中,比如红细胞的输注依赖、基因突变,特别是基因突变可能有助于更精准的预后评估。
4.3 三、治疗
MDS 治疗宜根据 MDS 患者的预后分组,同时结合患者年龄、体能状况、合并疾病、治疗依从性等进行综合分析,选择治疗方案。MDS可按预后积分系统分为2组:较低危组[IPSS低危组、中危-1 组,IPSS-R 极低危组、低危组和中危组(≤3.5 分),WPSS 极低危组、低危组和中危组]和较高危组[IPSS中危-2 组、高危组,IPSS-R 中危组(>3.5 分)、高危组和极高危组,WPSS 高危组和极高危组]。MDS-EB 阶段患者如伴随血细胞计数减少,基本都在较高危组,其治疗目标是延缓疾病进展、延长生存期和治愈。
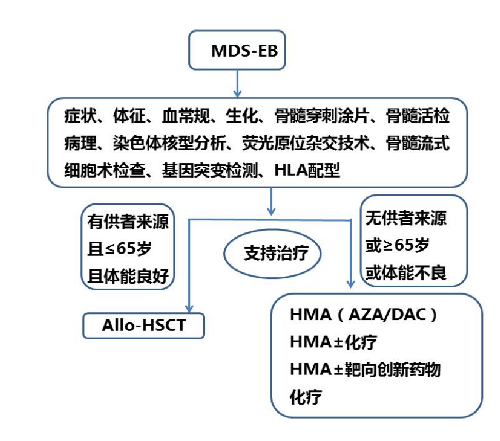
4.3.1 (一)支持治疗。
支持治疗最主要目标为提升患者生活质量。对于MDS-EB患者主要包括成分输血:一般在血红蛋白<60 g/L 或伴有明显贫血症状时可给予红细胞输注。患者为老年、机体代偿能力受限、需氧量增加时,建议血红蛋白≤80g/L 时给予红细胞输注。血小板计数<10×109/L 或有活动性出血时,应给予血小板输注。
4.3.2 (二)去甲基化药物。
常用的去甲基化药物包括5-阿扎胞苷(azacitidine,AZA)和 5-氮杂-2’-脱氧胞苷酸(decitabine,地西他滨)。去甲基化药物应用于较高危组MDS 患者,与支持治疗组相比,去甲基化药物治疗组可降低患者向AML 进展的风险、改善生存。
4.3.2.1 1.AZA:
推荐用法为每日 75 mg/m2×7 日,皮下注射,28日为 1 个疗程。接受 AZA 治疗的MDS 患者,首次获得治疗反应的中位时间为 3 个疗程,约90%治疗有效的患者在6个疗程内获得治疗反应。因此,推荐MDS 患者接受AZA 治疗6个疗程后评价治疗反应,有效患者可持续使用。
4.3.2.2 2.地西他滨:
推荐方案为每日20 mg/m2×5 日,每4周为 1 个疗程。推荐 MDS 患者接受地西他滨治疗4~6个疗程后评价治疗反应,有效患者可持续使用。
4.3.3 (三)化疗。
较高危组尤其是原始细胞比例增高的MDS-EB 患者预后较差,化疗是选择非造血干细胞移植(hematopoieticstemcell transplantation,HSCT)患者的治疗方式之一。可采取 AML 标准 3+7 诱导方案或预激方案。预激方案在国内广泛应用于较高危 MDS 患者,为小剂量阿糖胞苷(10 mg/m2,每12 小时 1 次,皮下注射,14 日)基础上加用粒细胞集落刺激因子,并联合阿克拉霉素或高三尖杉酯碱或去甲氧柔红霉素。预激方案治疗较高危 MDS 患者的完全缓解率可达40%~60%,且老年或身体机能较差的患者对预激方案的耐受性优于常规 AML 化疗方案。预激方案也可与去甲基化药物联合。
4.3.4 (四)创新药物。
BCL-2 抑制剂[(Venetoclax(VEN)]、免疫检查点抑制剂(程序性死亡蛋白-1 抑制剂抑制剂等)、口服组蛋白脱乙酰酶抑制剂及 CD47 单抗等联合去甲基化药物在高危MDS治疗获得初步可观结果,未来有可能改善MDS-EB 患者的总体预后。
4.3.5 (五)异基因造血干细胞移植。
异基因造血干细胞移植(allogeneic hematopoieticstem cell transplantation,allo-HSCT)是目前唯一能根治 MDS 的方法,造血干细胞来源包括同胞全相合供者、非血缘供者和单倍型相合血缘供者。allo-HSCT 的适应证为:①年龄<65 岁、较高危组 MDS 患者;②年龄<65 岁、伴有严重血细胞减少、经其他治疗无效或伴有不良预后遗传学异常(如-7、3q26 重排、TP53 基因突变、复杂核型、单体核型)的较低危组患者。拟行 allo-HSCT 的MDS-EB 患者,在等待移植的过程中可应用化疗或去甲基化药物或二者联合桥接allo-HSCT,但不应耽误移植的进行。
4.4 四、疗效和随访
是基于 MDS 国际工作组(International WorkingGroup,IWG)2000 年提出、2006 年修订的国际统一疗效标准。MDS的治疗反应包括以下 4 种类型。
4.4.1 (一) 改变疾病的自然病程。
4.4.1.1 1.完全缓解:
骨髓:原始细胞≤5%且所有细胞系成熟正常。外周血:原始细胞为 0,血红蛋白≥110 g/L,中性粒细胞≥1.0×109/L,血小板≥100×109/L。
4.4.1.2 2.部分缓解:
外周血绝对值必须持续至少2 个月,其他条件均达到完全缓解标准(凡治疗前有异常者),但骨髓原始细胞仅较治疗前减少≥50%,但仍>5%,不考虑骨髓细胞增生程度和形态学。
4.4.1.3 3.骨髓 CR:
骨髓:原始细胞≤5%且较治疗前减少≥50%;外周血:如果达到血液学改善,应同时注明。
4.4.1.4 4.疾病稳定:
未达到部分缓解的最低标准但至少8周以上无疾病进展证据。
4.4.1.5 5.失败:
治疗期间死亡或病情进展,表现为血细胞减少加重、骨髓原始细胞增高或较治疗前发展为更进展的FAB亚型。
4.4.1.6 6.进展:
原始细胞<5%者:原始细胞增加≥50%达到5%;原始细胞 5%~10%者:原始细胞增加≥50%达到10%;原始细胞 10%~20%者:原始细胞增加≥50%达到20%;外周血:中性粒细胞或血小板较最佳缓解/疗效时下降≥50%;血红蛋白下降≥20 g/L;依赖输血。
4.4.2 (二)细胞遗传学反应。
1.完全反应:染色体异常消失且无新发异常。2.部分反应:染色体异常细胞比例减少≥50%。
4.4.3 (三)血液学改善。
1.红系反应(治疗前血红蛋白<110 g/L):血红蛋白升高≥15 g/L;红细胞输注减少,与治疗前比较,每8周输注量至少减少 4 U;仅治疗前血红蛋白≤90g/L 且需红细胞输注者才纳入红细胞输注疗效评估。
2.血小板反应(治疗前血小板<100×109/L):治疗前血小板>20×109/L 者,净增值≥30×109/L 或从<20×109/L 增高至>20×109/L 且至少增高100%。
3.中性粒细胞反应(治疗前中性粒细胞<1.0×109/L):增高 100%以上和绝对值增高>0.5×109/L。
4.血液学改善后进展或复发:至少有下列1 项:中性粒细胞或血小板较最佳疗效时下降≥50%,血红蛋白下降≥15g/L,依赖输血。
4.4.4 (四)改善生存质量。
使用各种问卷或 WHO 体能积分。
4.5 附录1:MDS-EB 患者的诊断治疗流程
4.6 附录2:骨髓增生异常综合征伴原始细胞增多(MDS-EB)诊疗指南(2022版)编写审定专家组
(按姓氏笔画排序)
组长:黄晓军
成员:王婧、付海霞、许兰平、江倩、江浩、张晓辉、杨申淼、张圆圆、贾晋松、黄晓军、路瑾